Головная боль дети рачин
1. Горюнова А. В., Маслова О. И., Дыбунов А. Г. Первичная головная боль у детей. Журн. неврол. психиатр. им. С. С. Корсакова. 2004; 5: 69–76.
2. Рачин А. П., Сергеев А. В., Авдеева Т. Г. Головная боль у детей (лекция). Проблемы амбулаторно-поликлинической педиатрии: Мат-лы Всеросс. семин. Москва–Смоленск. 2007. С. 147–177.
3. Рачин А. П., Юдельсон Я. Б., Сергеев А. В. Эпидемиология хронической ежедневной головной боли у детей и подростков. Боль. 2004; 2 (3): 27–30.
4. Anttila P., Metsahonkala L., Sillanpaa M. Long-term trends in the incidence of headache in Finnish schoolchildren. Pediatrics. 2006; 117 (6): 1197–1201.
5. Anttila P., Sourander A., Metsahonkala L. et al. Psychiatric symptoms in children with primary headache. J. Am. Acad. Child. Adolesc. Psychiatry. 2004; 43: 412–419.
6. Bille B. Migraine in childhood and it’s prognosis. Cephalalgia. 1981; 1: 71–75.
7. Bille B. Migraine in school children. A study of the incidence and short-term prognosis, and a clinical, psychological and electroencephalographic comparison between children with migraine and matched controls. Acta. Paediatr. 1962; 136: 1–151.
8. Headache classification subcommittee of the international headache society. The International classification of headache disorders: 2nd edition. Cephalalgia. 2004; 24 (1): 9–160.
9. Lewis D. Pediatric migraine. Neurol. Clin. 2009; 27 (2): 481–501.
10. Ozge A., Termine C., Antonaci F. et al. Overview of diagnosis and management of paediatric headache. Part I: diagnosis. J. Headache Pain. 2011; 12 (1): 13–23.
11. Рачин А. П. Головная боль напряжения у школьников (эпидемиология, клиника, лечение). Автореф. дис. … канд. мед. наук. Смоленск. 2002. 137 с.
12. Akyol A., Kiylioglu N., Aydin I. et al. Epidemiology and clinical characteristics of migraine among school children in the Menderes region. Cephalalgia. 2007; 27 (7): 781–787.
13. Karli N., Akgoz S., Zarifoglu M. et al. Clinical characteristics of tension-type headache and migraine in adolescents: a studentbased study. Headache. 2006; 46 (3): 399–412.
14. Lewis D., Kellstein D., Burke B. et al. Children’s ibuprofen suspension for the acute treatment of migraine headache. Headache. 2002; 42: 780–786.
15. Hamalainen M. L., Hoppu K., Santavuori P. R. Pain and disability in migraine or other recurrent headache as reported by children. Eur. J. Neurol. 1996; 3: 528–532.
16. Lewis D. Headaches in children and adolescents. Curr. Probl. Pediatr. Adolesc. Health Care. 2007; 37 (6): 207–246.
17. Lundqvist C., Clench-Aas J., Hofoss D., Bartonova A. Selfreported headache in schoolchildren: parents underestimate their children’s headaches. Acta. Paediatr. 2006; 95 (8): 940–946.
18. Sasmaz T., Bugdayci R., Ozge A. et al. Are parents aware of their schoolchildren’s headache? Eur. J. Public Health. 2004; 14 (4): 366–368.
19. Осипова В. В., Табеева Г. Р. Первичные головные боли. Практическое руководство. М.: ПАГРИ-Принт. 2007. 60 с.
20. Abu-Arefeh I., Russell G. Prevalence of headache and migraine in schoolchildren. BMJ. 1994; 309: 765–769.
21. Termine C., Ozge A., Antonaci F. et al. Overview of diagnosis and management of paediatric headache. Part II: therapeutic management. J. Headache Pain. 2011; 12 (1): 25–34.
22. Powers S., Patton S., Hommel K., Hershey A. Quality of life in childhood migraine: clinical aspects and comparison to other chronic illness. Pediatrics. 2003; 112: 1–5.
23. Powers S., Patton S., Hommell K., Hershey A. Quality of life in paediatric migraine: characterization of age-related effects using PedsQL 4.0. Cephalalgia. 2004; 24: 120–127.
24. Loder E., Burch R., Rizzoli P. The 2012 AHS/AAN guidelines for prevention of episodic migraine: a summary and comparison with other recent clinical practice guidelines. Headache. 2012; 52 (6): 930–945.
25. Маневич Т. М., Соколова Е. Д., Яхно Н. Н., Роговина Е. Г. Особен ности личности и психического состояния детей и подростков, страдающих хроническими головными болями напряжения. Журн. неврол. психиатр. им. С. С. Корсакова. 2004; 2: 11–15.
26. Роговина Е. Г. Особенности мигрени в детском и подростковом возрасте. Неврологический журн. 1999; 4: 27–31.
27. Miller V., Palermao T., Powers S. et al. Migraine headaches and sleep disturbances in children. Headache. 2003; 43: 362–368.
28. Koseoglu E., Akboyraz A., Soyuer A., Ersoy A. O. Aerobic exercise and plasma beta endorphin levels in patients with migrainous headache without aura. Cephalalgia. 2003; 23 (10): 972–976.
29. Millichap J., Yee M. The diet factor in pediatric and adolescent migraine. Pediatric. Neurol. 2003; 28: 9–15.
30. Gibb C., Davies P., Glover V. et al. Chocolate is a migraine provoking agent. Cephalalgia. 1991; 11: 93–95.
31. Holroyd K., Mauskop A. Complementary and alternative treatments. Neurology. 2003; 60 (2): 58–62.
32. Amdorfer R., Allen K. Extending the efficacy of a thermal biofeedback treatment package to the management of tension-type headache in children. Headache. 2001; 41: 183–192.
33. Baumann R. J. Behavioral treatment of migraine in children and adolescents. Paediatr. Drugs. 2002; 4 (9): 555–561. 34. Bussone G., Grazzi L., D’Amical D. et al. Biofeedback assisted relaxation training for young adolescents with tension-type headache. Cephalalgia. 1998; 18: 463–467.
34. Lewis D., Diamond S., Scott D. Prophylactic treatment of pediatric migraine. Headache. 2004; 44: 230–237.
35. Fichtel A., Larsson B. Does relaxation treatment have differential effects on migraine and tension-type headache in adolescents? Headache. 2001; 41: 290–296.
36. Fichtel A., Larsson B. Relaxation treatment administered by school nurses to adolescents with recurrent headache. Headache. 2004; 44: 545–554.
37. Larsson B., Melin L., Doderl A. Recurrent tension headache in adolescent treated with self-help relaxation training and a muscle relaxant drug. Headache. 1990; 30: 665–671.
38. Olness K., MacDonald J. T., Uden D. L. Comparison of self hypnosis and propranolol in the treatment of juvenile classic migraine. Pediatrics. 1987; 79: 593–597.
Источник
В статье рассмотрено патогенетическое действие остеопатии при хронической головной боли напряжения
Введение
В настоящее время установлено, что для больных с хронической головной болью напряжения (ХГБН) [1–3] характерна актуальная недостаточность нисходящего тормозного контроля со стороны супрасегментарных структур ЦНС на сегментарные и релейные интернейроны, которые ответственны за проведение ноцицептивных афферентных потоков из зоны периферического ноцицептивного поля [4].
Лечение ХГБН представляет собой достаточно сложную задачу. Это обусловлено, прежде всего, необходимостью тщательного учета множества механизмов развития патологического процесса при различных вариантах головной боли напряжения (ГБН), а также дополнительных факторов, ведущих к возникновению смешанной головной боли (ГБ). В последние годы повысился интерес к использованию нелекарственных методов лечения различных вариантов ХГБН [5, 6].
Цель настоящего исследования: оценка эффективности влияния остеопатии на динамику клинических параметров цефалгии и психологического статуса, а также полисинаптическую рефлекторную возбудимость ствола мозга больных с ХГБН.
Материал и методы
В исследовании приняли участие 108 больных с ХГБН, средний возраст которых составил 38,4–0,64 года, в т. ч. 68 женщин и 40 мужчин. Для исследования эффективности остеопатии все больные с ХГБН случайным образом разделены на основную группу, группу сравнения и контрольную группу. В первую (основную) группу вошли 60 больных с ХГБН (34 женщины и 26 мужчин), средний возраст которых составил 41,3±1,6 года.
Важно отметить, что протокол остеопатического лечения ХГБН включал: восстановление подвижности крестца в крестцово-подвздошных суставах, L5–S1; устранение соматических дисфункций тазовой, грудобрюшной диафрагмы, верхней грудной апертуры; устранение соматических дисфункций поясничного, грудного, шейного отделов позвоночника (особенно краниоцервикального перехода), уравновешивание глубоких фасций шеи, а также восстановление свободной кинетики ключиц и первых ребер; устранение кинетических дисфункций сфенобазилярного синхондроза, коррекция швов костей основания черепа; работу на твердой мозговой оболочке; уравновешивание мембран черепа; ингибирование верхнего и нижнего шейных симпатических ганглиев; остеопатическую коррекцию соматических дисфункций внутренних органов; дренаж венозных синусов; техники на IV желудочке. При этом количество проводимых сеансов определялось динамикой клинико-неврологического статуса и составляло в среднем 4–8 процедур на курс, с частотой 1–2 раза в неделю [7–13].
Группу сравнения составили 48 больных с ХГБН, среди них 34 женщины и 14 мужчин, средний возраст – 42,1±1,2 года. Лечение включало стандартную терапию ХГБН классическим антидепрессантом амитриптилином в индивидуальной дозе от 50 до 100 мг/сут. Наряду с медикаментозной терапией все больные данной группы получали 6–8 сеансов мануальной терапии которая включала: постизометрическую релаксацию, ингибицию миофасциальных, связочных и периостальных триггерных точек перикраниальной зоны, а также суставную мобилизацию позвоночно-двигательных сегментов шейного отдела позвоночника.
Группу контроля составили 22 здоровых добровольца (15 женщин и 7 мужчин) от 22 до 50 лет (средний возраст 34,8–0,3 года), не страдающих синдромом хронической боли, клинически значимыми эмоционально-аффективными, личностными и вегетативными расстройствами.
Пациенты с ХГБН проходили обследование 3 раза. Первое клинико-функциональное обследование проводилось в течение первых дней от начала наблюдения, второе – не ранее чем через месяц после начала наблюдения и проведения терапии, третье – в период от 2-х до 3-х месяцев от начала наблюдения.
Протокол остеопатического осмотра проводился согласно общепринятым методическим рекомендациям [15, 16].
Электронейрофизиологическое исследование мигательного рефлекса (МР) проводилось на 2-канальном компьютерном электромиографе «Нейро-ЭМГ» («Нейрософт», Россия). Анализировали следующие показатели МР: порог вызывания R1–R3 компонентов МР, а также его длительность и максимальную амплитуду [17].
Для выявления аффективных расстройств и особенностей личностного реагирования в работе использовался Миннесотский многопрофильный личностный тест (MMPI) [18]. Для количественной оценки (в баллах) уровня реактивной и личностной тревожности – тест Спилбергера. Тест Бека применялся для количественной оценки (в баллах) уровня депрессивной реакции. При необходимости с диагностической целью назначались рентгенография различных отделов позвоночника, черепа, компьютерная и магнитно-резонансная томография головного мозга и позвоночника, электроэнцефалография, реоэнцефалография, УЗИ сосудов головного мозга, а также другие необходимые методы исследования. Статистический анализ проводился на персональном компьютере с использованием программ MS Excel 2003 (Microsoft).
Результаты исследования
Как показали результаты выполненного нами исследования, все больные с ХГБН предъявляли жалобы на симметричные, стягивающие, ноющие, непульсирующие ГБ умеренной интенсивности, которые в 47,6% наблюдений беспокоили ежедневно, в 17,6% – были практически постоянными, в 66,4% – возникали без очевидной связи с какими-либо провоцирующими факторами.
Важно отметить, что наряду с указанными болевыми ощущениями в 53,2% наблюдений также отмечались односторонние непульсирующие ГБ, а в 39,8% наблюдений – односторонние ГБ пульсирующего характера по типу мигренозных. На высоте ГБ у 42,6% больных отмечалась тошнота, у 14,3% – головокружение, у 11,7% – фото- и (или) фонофобия, а у 6,9% – рвота.
У больных с ХГБН выявлялась характерная тенденция к распространению спонтанных болевых ощущений в смежные и отдаленные анатомические отделы: шею, реже межлопаточную область, иногда в плечо. Обычно дополнительные болевые ощущения возникали на фоне уже имеющейся ГБ.
Активные миофасциальные триггерные пункты (МФТП) в мышцах головы преимущественно регистрировались в надчерепной (лобное и затылочное брюшко) и височной мышцах. Клинически они обычно характеризовались минимальными размерами (не более 0,5 см) и умеренной болезненностью при пальпации.
В экстракраниальной мускулатуре активные МФТП обычно определялись в грудино-ключично-сосцевидной и трапециевидной мышцах. Также отмечалось вовлечение и другой мускулатуры, включая ременную и полуостистую мышцу головы, большую и малую ромбовидные, надостную и подостную мышцы. Почти всегда активные МФТП преобладали на стороне преимущественной ГБ. Пальпаторная стимуляция МФТП в экстракраниальной мускулатуре вызывала отраженные боли на одноименной стороне в лобной, височной и затылочной областях. Активные МФТП в экстракраниальных мышцах выявлялись у 86,5%.
Результаты исследования эмоционально-аффективных реакций
Как показали результаты нашего исследования, ХГБН в 94,8% наблюдений сопутствовали проявления психоэмоциональной дисфункции. Наиболее частыми симптомами являлись: раздражительность – 79,5%, тревожность – 62,2%, пониженное настроение – 37,9%, нарушенный сон – 74,6%. На высоте болевых ощущений определялось повышение уровня тревоги (подъем по шкале 2 до уровня 75–85 баллов) и тенденция к развитию депрессивной реакции (снижение по шкале 9 до уровня 45–55 баллов). Вне эпизода ГБ обычно сохранялся уровень тревоги (подъем по шкале 2 до уровня 70–75 баллов) и уровень депрессивной реакции. Отчетливо также демонстрировалась депрессивная реакция у больных с ХГБН (подъем по шкале 2 выше 75 баллов, снижение по шкале 9 ниже 45 баллов). Отмечалась корреляция эмоционально-аффективных расстройств с течением болевого синдрома. Так, выраженность и тревожной и депрессивной реакции была достоверно выше при тестировании в период манифестации болевого синдрома и достоверно ниже при тестировании вне эпизода, приступа или периода усиления ГБ. Анализ индивидуальных профилей личности теста MMPI установил частое наличие отклонений по шкалам 1, 3, 6, 7, 8, 0. Все это характеризовало актуальность личностных акцентуаций у больных с различными видами ГБ. В 26% наблюдений у больных с ХГБН диагностировался демонстративный (истерический) тип личности (подъем по шкале 3 до уровня 70–85 баллов и сопутствующий подъем по шкале 1, при этом уровень по шкалам возрастал в порядке 3>1>2). Высокий процент встречаемости характерологических особенностей у больных с ГБ подтверждает роль конституциональных патофизиологических отличий нервной системы в развитии хронической боли. Это также диктует настоятельную необходимость учета особенностей личности больных при планировании комплексной терапии и тактики общения с пациентами, а также при оценке возможного прогноза течения патологического процесса под влиянием терапии.
Результаты остеопатического обследования
Исходные результаты остеопатического обследования в исследуемых группах больных с ХГБН свидетельствовали о множественности тех или иных соматических дисфункций. Необходимо подчеркнуть, что достоверных различий в количестве и видах соматических дисфункций среди данных групп нами не обнаружено. Это позволило считать корректным сравнение динамики соматических дисфункций на фоне лечения у обследованных нами больных. Нарушение функционирования краниосакральной системы у больных с ХГБН проявлялось в замедлении ритма, снижении частоты и амплитуды подвижности. Нефизиологические паттерны cфенобазилярного синхондроза были выявлены у 49,8% всех испытуемых, внутрикостные соматические дисфункции костей черепа – у 65%, дисфункция швов костей черепа – у 58%. Среди них: сфено-сквамозный, сфено-петрозный, окципито-мастоидальный, петро-югулярный, петро-базилярный, сквамо-париетальный.
Следует обратить особенное внимание на то, что соматические дисфункции шейного отдела позвоночника были выявлены у 97% пациентов основной группы и 95% из группы сравнения. При этом преобладали дисфункции верхнего шейного отдела (С0–С2) у пациентов обеих групп (65% и 59,7% соответственно), далее по частоте диагностировались дисфункции средне-нижнего отдела и шейно-грудного перехода (С5–С7 и С7–Th1) (38,8, 42,9, 35,5% и 41% соответственно), и реже среднего шейного отдела (С3–С5) (27,6% и 21%).
Соматическая дисфункция верхней грудной апертуры была выявлена у 79,2% пациентов основной группы и 77,7% группы сравнения. При этом правосторонняя дисфункция встречалась в 53,3% и 48,7% случаев, левосторонняя в 27,5% и 31% соответственно.
Соматическая дисфункция грудобрюшной диафрагмы была выявлена у половины пациентов (51,7% и 55%), справа больше (26,7% и 33,3%), чем слева (20% и 13,3%). Двухсторонняя дисфункция встречалась в 5% и 8,3% наблюдений соответственно.
Результаты исследования полисинаптической рефлекторной возбудимости ствола мозга
Латентные периоды R1 и R2 у здоровых лиц в среднем составили 9,1±0,13 мс и 31,3±0,28 мс соответственно. Длительность рефлекторного ответа для R1 не превышала 9,4±0,18 мс, при этом его амплитуда составила 312,2±8,15 мкВ. В свою очередь, длительность R2 находилась в пределах 43,8±1,57 мс, а значения его амплитуды – в пределах 428,4±7,42 мкВ.
У 91,2% больных с ХГБН установлено практически полное доминирование «гипервозбудимого» типа МР. Наиболее характерным по сравнению со здоровыми испытуемыми даже в период минимальных болевых ощущений было существенное увеличение длительности R2 компонента МР (49,1±4,6 мс) (p<0,01), сокращение его латентности (32,2±1,2 мс) (p<0,01) и уменьшение порога (1,1±0,2 мА) (p<0,01).
На высоте болевых ощущений наблюдалась очевидная тенденция к еще большему увеличению длительности (56,1±4,1 мс), дальнейшему сокращению латентности (30,0±1,3 мс) и снижению порога (0,7±0,1 мА) R2 компонента МР.
Применение корреляционного анализа в группах ХГБН позволило установить наличие прямых связей между длительностью R2 компонента МР и частотой ГБ (r=0,7; p<0,01), интенсивностью ГБ (r=0,52; p<0,05) и длительностью ГБ (r=0,55; p<0,05).
Таким образом, полученные данные характеризуют связь уровня полисинаптической рефлекторной возбудимости (ПРВ) с тяжестью ГБ. Так, для ХГБН характерно значительное и постоянное повышение уровня ПРВ с изменением типа ответа на «гипервозбудимый». Очевидно, это подтверждает роль нарушений процессов торможения и функционального дефицита антиноцицептивной системы в механизмах прогрессирования хронических ГБ.
Результаты лечения ХГБН
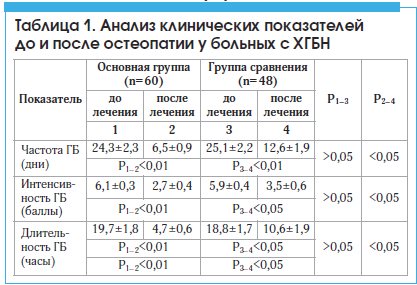
Сравнительный анализ клинических характеристик болевого синдрома показал, что в основной группе, на фоне остеопатического лечения, отмечалось достоверное уменьшении частоты ГБ (p<0,05) и снижение интенсивности ГБ (p<0,05). Имело место также достоверное уменьшение длительности ГБ (p<0,05). Результаты данного раздела представлены в таблице 1. 
У больных с ХГБН основной группы отмечалась также достоверно бо́льшая динамика по шкале тревоги/депрессии (p<0,05), что свидетельствовало об уменьшении эмоционально-аффективных расстройств (табл. 2).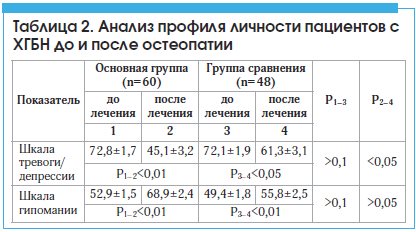
Остеопатическое лечение вызывало достоверно бо́льшее снижение исходно высокой полисинаптической рефлекторной возбудимости, что отражалось в достоверном повышении порога и уменьшении длительности R2 компонента МР (табл. 3). 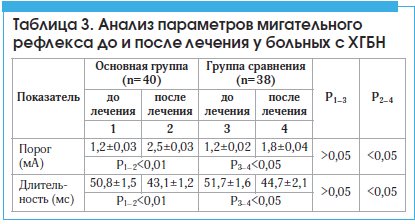
Таким образом, результаты проведенного исследования позволяют говорить о том, что совокупная динамика клинических, психологических и нейрофизиологических показателей характеризует направленное патогенетическое действие остеопатии на основные механизмы развития ХГБН [19].
Выводы
1. Метод остеопатии повышает клиническую эффективность лечения больных с ХГБН. Этот факт подтверждается достоверной положительной динамикой клинических и психологических показателей.
2. Остеопатия вызывает нормализацию полисинаптической рефлекторной возбудимости ствола мозга, которая является маркером функционального состояния механизмов тормозного контроля антиноцицептивной системы.
3. Остеопатия в основном должна быть направлена на такие звенья патогенеза ХГБН, как эмоционально-аффективные нарушения; биомеханические, респираторно-циркуляторные и невральные соматические дисфункции; функциональное состояния сегментарных и супрасегментарных структур ноцицептивной и антиноцицептивной систем; активные зоны ноцицептивной афферентации [20–22].
Источник


