Озон головная боль планеты

МОСКВА, 16 сен — РИА Новости. Международный день охраны озонового слоя, тонкого «щита», защищающего все живое на Земле от губительного ультрафиолетового излучения Солнца, отмечается в понедельник, 16 сентября — в этот день в 1987 году был подписан знаменитый Монреальский протокол.
В нормальных условиях озон, или O3, — бледно-голубой газ, который по мере охлаждения превращается в темно-синюю жидкость, а затем и в иссиня-черные кристаллы. Всего на озон в атмосфере планеты приходится около 0,6 части на миллион по объему: это значит, например, что в каждом кубометре атмосферы всего 0,6 кубического сантиметра озона. Для сравнения, углекислого газа в атмосфере уже около 400 частей на миллион — то есть больше двух стаканов на тот же кубометр воздуха.
На самом деле, такую небольшую концентрацию озона можно назвать благом для Земли: этот газ, который на высоте 15-30 километров образует спасительный озоновый слой, в непосредственной близости от человека куда менее «благороден». Озон по российской классификации относится к веществам наивысшего, первого класса опасности — это очень сильный окислитель, который крайне токсичен для человека.
Разобраться в разных свойствах непростого озона РИА Новости помогал старший научный сотрудник лаборатории катализа и газовой электрохимии химического факультета МГУ имени Ломоносова Вадим Самойлович.
Озоновый щит
«Это достаточно хорошо изученный газ, практически все изучено — всего никогда не бывает, но основное все (известно)… У озона много всяких применений. Но и не забывайте, что, вообще говоря, жизнь возникла благодаря озоновому слою — это, наверное, главный момент», — говорит Самойлович.
В стратосфере озон образуется из кислорода в результате фотохимических реакций — такие реакции начинаются под воздействием солнечного излучения. Там концентрация озона уже выше — около 8 миллилитров на кубический метр. Разрушается газ при «встрече» с некоторыми соединениями, например, атомарным хлором и бромом — именно эти вещества входят в состав опасных хлорфторуглеродов, более известных как фреоны. До появления Монреальского протокола они использовались, в частности, в холодильной промышленности и как пропелленты в газовых баллончиках.
В 2012 году, когда Монреальский протокол отмечал 25-летие, эксперты Программы ООН по окружающей среде (UNEP) назвали защиту озонового слоя одной из всего четырех ключевых экологических проблем, в решении которой человечеству удалось добиться значительных успехов. Тогда же в UNEP отмечали, что содержание озона в стратосфере перестало снижаться с 1998 года, и, по прогнозам ученых, к 2050-2075 годам может вернуться к уровням, фиксировавшимся до 1980 года.
Озоновый смог
В 30 километрах от поверхности Земли озон «ведет себя» хорошо, но в тропосфере, приземном слое, он оказывается опасным загрязнителем. По данным UNEP, концентрация тропосферного озона в Северном полушарии за последние 100 лет выросла почти втрое, что к тому же делает его третьим по значимости «антропогенным» парниковым газом.
Здесь озон тоже не выбрасывается в атмосферу, а образуется под действием солнечного излучения в воздухе, который уже загрязнен «предшественниками» озона — оксидами азота, летучими углеводородами и некоторыми другими соединениями. В городах, где озон является одним из основных компонентов смога, в его появлении косвенно «виноваты» главным образом выбросы автотранспорта.
Страдают от приземного озона не только люди и климат. По оценкам специалистов UNEP, снижение концентрации тропосферного озона может помочь сохранить около 25 миллионов тонн риса, пшеницы, сои и кукурузы, которые ежегодно теряются из-за этого токсичного для растений газа.
Именно из-за того, что приземный озон уже совсем не так полезен, специалисты метеослужб и экологического мониторинга постоянно ведут наблюдение за его концентрациями в воздухе крупных городов, в том числе и Москвы.
Озон полезный
«Одно из очень интересных свойств озона — бактерицидное. Он по бактерицидности практически первый среди всех таких веществ, хлора, перекиси марганца, окиси хлора», — отмечает Вадим Самойлович.
Та же экстремальная природа озона, делающая его очень сильным окислителем, объясняет сферы применения этого газа. Озон используется для стерилизации и дезинфекции помещений, одежды, инструментов и, конечно, очистки воды — как питьевой, так и промышленной и даже сточной.
Кроме того, подчеркивает эксперт, озон во многих странах используется как заменитель хлора в установках для отбеливания целлюлозы.
«Хлор (при реакции) с органикой дает соответственно хлорорганику, которая гораздо более ядовитая, чем просто хлор. По большому счету, избежать этого (появления ядовитых отходов — ред.) можно либо резко уменьшив концентрацию хлора, либо просто устранив его. Один из вариантов — замена хлора на озон», — объяснил Самойлович.
Озонировать можно и воздух, и это тоже дает интересные результаты — так, по словам Самойловича, в Иванове специалисты ВНИИ охраны труда и их коллеги провели целую серию исследований, в ходе которых «в прядильных цехах в обычные воздуховоды вентиляции добавляли некоторое количество озона». В результате, распространенность респираторных заболеваний уменьшалась, а производительность труда, напротив, росла. Озонирование воздуха на складах пищевой продукции может повышать ее сохранность, и такие опыты в других странах тоже есть.
Озон токсичный
Подвох с использованием озона все тот же — его токсичность. В России предельно допустимая концентрация (ПДК) по озону в атмосферном воздухе составляет 0,16 миллиграмма на кубический метр, а в воздухе рабочей зоны — 0,1 миллиграмма. Поэтому, отмечает Самойлович, то же озонирование требует постоянного мониторинга, что сильно усложняет дело.
«Это все-таки техника достаточно сложная. Вылить ведро какого-нибудь там бактерицида — это проще гораздо, вылил и все, а тут следить надо, какая-то подготовка должна быть», — говорит ученый.
Озон вредит организму человека медленно, но серьезно — при длительном нахождении в загрязненном озоном воздухе возрастает риск сердечно-сосудистых заболеваний и болезней дыхательных путей. Вступая в реакцию с холестерином, он образует нерастворимые соединения, что приводит к развитию атеросклероза.
«При концентрациях выше предельно допустимых могут возникать головная боль, раздражение слизистых, кашель, головокружение, общая усталость, упадок сердечной деятельности. Токсичный приземной озон приводит к появлению или обострению болезней органов дыхания, в группе риска находятся дети, пожилые люди, астматики», — отмечается на сайте Центральной аэрологической обсерватории (ЦАО) Росгидромета.
Озон взрывоопасный
Озон вредно не только вдыхать — спички тоже стоит спрятать подальше, потому что этот газ весьма взрывоопасен. Традиционно «порогом» опасной концентрации газообразного озона считается 300-350 миллилитров на литр воздуха, хотя некоторые ученые работают и с более высокими уровнями, говорит Самойлович. А вот жидкий озон — та самая синяя жидкость, темнеющая по мере охлаждения — взрывается самопроизвольно.
Именно это мешает использовать жидкий озон как окислитель в ракетном топливе — такие идеи появились вскоре после начала космической эры.
«Наша лаборатория в университете возникла как раз на такой идее. У каждого топлива ракетного есть своя теплотворная способность в реакции, то есть сколько тепла выделяется, когда оно сгорает, и отсюда насколько мощной будет ракета. Так вот, известно, что самый мощный вариант — жидкий водород смешивать с жидким озоном… Но есть один минус. Жидкий озон взрывается, причем взрывается спонтанно, то есть без каких-либо видимых причин», — говорит представитель МГУ.
По его словам, и советские, и американские лаборатории потратили «огромное количество сил и времени на то, чтобы сделать это каким-то безопасным (делом) — выяснилось, что сделать это невозможно». Самойлович вспоминает, что однажды коллегам из США удалось получить особо чистый озон, который «вроде бы» не взрывался, «уже все били в литавры», но затем взорвался весь завод, и работы были прекращены.
«У нас были случаи, когда, скажем, колба с жидким озоном стоит, стоит, жидкий азот подливают туда, а потом — то ли азот там выкипел, то ли что — приходишь, а там половины установки нет, все разнесло в пыль. Отчего он взорвался — кто его знает», — отмечает ученый.
Источник
Озон – это газ. В отличие от многих других он не прозрачный, а имеет характерный цвет и даже запах. Он присутствует в нашей атмосфере и является одним из важнейших её составляющих. Какова плотность озона, его масса и другие свойства? Какова его роль в жизни планеты?
Голубой газ
В химии озон не имеет отдельного места в таблице Менделеева. Все потому, что он не является элементом. Озон – это аллотропная модификация или же вариация кислорода. Как и в О2, его молекула состоит только из атомов кислорода, но имеет их не два, а три. Поэтому его химическая формула выглядит как О3.
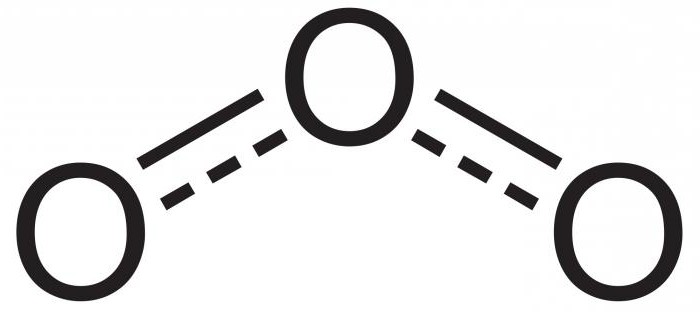
Озон является газом голубого цвета. Он обладает хорошо заметным резким запахом, напоминающим хлор, если концентрация будет слишком большой. Вы помните запах свежести во время дождя? Это и есть озон. Благодаря такому свойству он и получил своё название, ведь с древнегреческого языка «озон» — это «пахну».
Молекула газа полярна, атомы в ней соединяются под углом 116,78°. Озон образуется, когда к молекуле О2 присоединяется свободный атом кислорода. Происходит это во время различных реакций, например, окисления фосфора, электрического разряда или разложения перекисей, в ходе которых и освобождаются атомы оксигена.
Свойства озона
При нормальных условиях озон существует в виде газа с молекулярной массой почти 48 г/моль. Он является диамагнетиком, то есть не способен притягиваться к магниту, точно так же, как серебро, золото или азот. Плотность озона составляет 2,1445 г/дм³.
В твердом состоянии озон приобретает иссиня-черный цвет, в жидком – цвет индиго, близкий к фиолетовому. Температура кипения при этом составляет 111,8 градусов Цельсия. При температуре нуль градусов он растворяется в воде (только в чистой) в десять раз лучше кислорода. Он отлично смешивается с жидким метаном, азотом, фтором, аргоном, а при определенных условиях и с кислородом.

Под действием ряда катализаторов легко окисляется, выделяя при этом свободные атомы кислорода. Соединяясь с ним, тут же воспламеняется. Вещество способно окислить практически все металлы. Не поддаются его действию только платина и золота. Он разрушает различные органические и ароматические соединения. При контакте с аммиаком образует нитрит аммония, разрушает двойные углеродные связи.
Присутствуя в атмосфере в больших концентрациях, озон самопроизвольно разлагается. При этом выделяется тепло и образуется молекула О2. Чем выше его концентрация, тем сильнее реакция тепловыделения. При содержании озона больше 10% она сопровождается взрывом. При увеличении температуры и снижении давления или при контакте с органическими веществами разложение О3 происходит быстрее.
История открытия
В химии озон не был известен до XVIII века. Обнаружен он был в 1785 году благодаря запаху, который физик Ван Марум услышал рядом с работающей электростатической машиной. Ещё 50 лет после этого газ никак не фигурировал в научных экспериментах и исследованиях.
Ученый Кристиан Шёнбейн в 1840 году изучал окисление белого фосфора. Во время экспериментов ему удалось выделить неизвестное вещество, которое он назвал «озон». Химик вплотную занялся изучением его свойств и описал способы получения вновь открытого газа.
Вскоре к исследованиям вещества подключились и другие ученые. Знаменитый физик Никола Тесла даже соорудил первый в истории генератор озона. Промышленное использование О3 началось в конце XIX века с появлением первых установок для подачи в дома питьевой воды. Вещество применяли для дезинфицирования.

Озон в атмосфере
Наша Земля окружена невидимой оболочкой из воздуха – атмосферой. Без неё жизнь на планете была бы невозможна. Составляющие атмосферного воздуха: кислород, озон, азот, водород, метан и другие газы.
Сам по себе озон не существует и возникает только в результате химических реакций. Близко к поверхности Земли он образуется за счет электрических разрядов молнии во время грозы. Неестественным путем он появляется благодаря выбросам выхлопных газов автомобилей, заводов, испарениям бензина, действию тепловых электростанций.

Озон нижних слоев атмосферы называют приземным или тропосферным. Существует и стратосферный. Он возникает под действием ультрафиолетового излучения, идущего от Солнца. Он образуется на расстоянии 19-20 километров над поверхностью планеты и тянется до высоты 25-30 километров.
Стратосферный О3 формирует озоновый слой планеты, который защищает её от мощной солнечной радиации. Он поглощает примерно 98% ультрафиолетового излучения с длиной волны, достаточной для возникновения раковых заболеваний и ожогов.
Применение вещества
Озон – это отличный окислитель и разрушитель. Такое свойство давно используется для очищения питьевой воды. Вещество губительно действует на опасные для человека бактерии и вирусы, а само при окислении превращается в безвредный кислород.
Он способен убить даже стойких к хлору организмов. Кроме того, его применяют для очищения сточных вод от губительных для окружающей среды нефтепродуктов, сульфидов, фенолов и т.д. Такие практики распространены в основном на территории США и некоторых стран Европы.
Озон применяют в медицине для обеззараживания инструментов, в промышленности с его помощью отбеливают бумагу, очищают масла, получают различные вещества. Применение О3 для очистки воздуха, воды и помещения называется озонированием.

Озон и человек
Несмотря на все свои полезные свойства, озон может быть опасен для человека. Если в воздухе газа окажется больше, чем может перенести человек, отравления не избежать. В России его допустимая норма составляет 0,1 мкг/л.
При превышении этой нормы появляются типичные признаки химического отравления, такие как головная боль, раздражение слизистых, головокружение. Озон уменьшает сопротивление организма к инфекциям, передающимся через дыхательные пути, а также снижает давление крови. При концентрации газа выше 8–9 мкг/л возможен отек легких и даже смерть.
При этом распознать озон в воздухе достаточно легко. Запах «свежести», хлора или «раков» (как утверждал Менделеев) отчетливо слышен и при незначительном содержании вещества.
Источник
У этого термина существуют и другие значения, см. Озон (значения).
| Озон | ||
|---|---|---|
| Систематическое наименование | Трикислород | |
| Хим. формула | O3 | |
| Состояние | голубой газ | |
| Молярная масса | 47,998 г/моль | |
| Плотность | 0,0021445 г/см3 (г., 0°C); 1,59(7) г/см3 (ж., 85,2 К); 1,73(2) г/см3 (тв., 77,4 К)[1] | |
| Поверхностное натяжение | 43,8 Н/м (77,4 К); 38,4 Н/м (90,2 К)[1] Н/м | |
| Динамическая вязкость | 4,17 мПа·с (77,6 К); 1,56(2) мПа·с (90,2 К)[1] | |
| Энергия ионизации | 12,52 ± 0,01 эВ[3] | |
| Температура | ||
| • плавления | −197,2 °C | |
| • кипения | −111,9 °C | |
| Критическая точка | ||
| • температура | −12,0 °С (261,1 К)[1] °C | |
| • давление | 54,6 атм.[1] | |
| Мол. теплоёмк. | 85,354 − 0,2812·(T − 90) (ж., при T от 90 до 160 К)[1] Дж/(моль·К) | |
| Энтальпия | ||
| • образования | 144,457 (при 0 К, отн. О2)[1] кДж/моль | |
| Коэфф. тепл. расширения | 2,0·10−3 К−1 (ж., 90,1 К) 2,5·10−3 К−1 (ж., 161 К)[1] | |
| Давление пара | 1 ± 1 атм[3] | |
| Растворимость | ||
| • в воде | 1,06 г/л (при 0 °С)[2] | |
| Диэлектрическая проницаемость | 1,0019 (г), 4,79 (ж)[1] | |
| Показатель преломления | 1,0533 (г., 480 нм) 1,0520 (г., 546 нм) 1,0502 (г., 671 нм) 1,2236 (ж., 535 нм) 1,2226 (ж., 589 нм) 1,2213 (ж., 670,5 нм)[1] | |
| Дипольный момент | 0,5337 Д | |
| Рег. номер CAS | 10028-15-6 | |
| PubChem | 24823 | |
| Рег. номер EINECS | 233-069-2 | |
| SMILES | [O-][O+]=O | |
| InChI | 1S/O3/c1-3-2 CBENFWSGALASAD-UHFFFAOYSA-N | |
| RTECS | RS8225000 | |
| ChEBI | 25812 | |
| ChemSpider | 23208 | |
| ЛД50 | 4,8 ppm | |
| Токсичность | сильнодействующий яд, обладающий раздражающим, канцерогенным и мутагенным действием | |
| Пиктограммы СГС | ||
| NFPA 704 | 4 4 OX | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
| Медиафайлы на Викискладе | ||
Озо́н (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3аллотропная модификация кислорода. При нормальных условиях — голубой ядовитый газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, серые, практически чёрные кристаллы.
Строение озона[править | править код]
Обе связи O—O в молекуле озона имеют одинаковую длину 1,278 Å. Угол между связями составляет 116,8°[4]. Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи — 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной — с другим, и наоборот. Молекула полярна, электрический дипольный момент — 0,5337 Д[5].
История открытия[править | править код]
Впервые озон обнаружил в 1785 году голландский физик М. ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр, а также по способности действовать на ртуть при обыкновенной температуре, вследствие чего она теряет свой блеск и начинает прилипать к стеклу[6]. Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».
Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века. Многие источники именно ему отдают приоритет открытия озона в 1839 году. В 1840 году Шёнбейн показал способность озона вытеснять иод из иодида калия[6]:
Эту реакцию используют для качественного определения озона с помощью фильтровальной бумаги, пропитанной смесью растворов крахмала и иодида калия (иодкрахмальной бумаги) — она в озоне синеет ввиду взаимодействия выделяющегося иода с крахмалом[7].
Факт уменьшения объёма газа при превращении кислорода в озон экспериментально доказали в 1860 году Эндрюс и Тэт при помощи стеклянной трубки с манометром, наполненной чистым кислородом, со впаянными в неё платиновыми проводниками для получения электрического разряда[6].
Физические свойства[править | править код]
- Молекулярная масса — 48 а.е.м.
- Плотность газа при нормальных условиях 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху 1,62 (1,658[8]).
- Плотность жидкости при −188 °C (85,2 К) составляет 1,59(7) г/см³[1].
- Плотность твёрдого озона при −195,7 °С (77,4 К) равна 1,73(2) г/см3[1].
- Температура кипения −111,8(3) °C (161,3 К)[1]. Жидкий озон — тёмно-фиолетового цвета.
- Температура плавления −197,2(2) °С (75,9 К) Приводимая иногда т.пл. −251,4 °C (21,7 К) ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению[9]. По другим сведениям[1]Tпл = −192,5(4) °С (80,6 К). В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
- Критическая температура −12,0 °С (261,1 К)[1].
- Критическое давление 51,6 атм[1].
- Коэффициент диффузии (при 300 К, 1 атм) 0,157 см2/с[1].
- Теплота плавления 2,1 кДж/моль[1].
- Теплота испарения при температуре кипения в различных источниках указывается от 11,17 до 15,19 кДж/моль[1]; при 90 К от 15,27 до 16,6 кДж/моль[1].
- Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом. Кажущаяся растворимость сильно зависит от чистоты воды, поскольку примеси катализируют распад озона.
- Жидкий озон смешивается во всех отношениях с жидкими аргоном, азотом, фтором, метаном, углекислотой, тетрахлоруглеродом. Смешивается с жидким кислородом во всех отношениях при температуре выше 93 К, ниже этой температуры раствор расслаивается на две фазы[1].
- Хорошо растворяется в фреонах, образуя стабильные растворы (используется для хранения и перевозки).
- Потенциал ионизации молекулы 12,52 эВ[1].
- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
- Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100000.
Химические свойства[править | править код]
Образование озона проходит по обратимой реакции:
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут[10] превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств HNO3 озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины[11] и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Озон не реагирует с молекулярным азотом при комнатной температуре, но при 295°С вступает с ним в реакцию:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый перхлорат нитрония (англ.)русск. может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего[12]:
Озон может образовывать неорганические озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия[13]:
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+[14]:
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция[12]:
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину[15] :
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам.
Получение озона[править | править код]
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария[7]:
Биологические свойства[править | править код]
Высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его высокую токсичность. Воздействие озона на организм является общетоксическим, раздражающим, канцерогенным и мутагенным, а также может приводить к преждевременной смерти[16].
Наиболее опасное воздействие высоких концентраций озона в воздухе:
- на органы дыхания прямым раздражением;
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону:
- максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³[17];
- среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³[17];
- предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³.
- Минимальная смертельная концентрация (LC50) — 4,8 ppm
При этом, порог человеческого обоняния приближённо равен 0,01 мг/м³[18].
Озон эффективно убивает плесень и бактерии.
Применение озона[править | править код]
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения;
- при получении многих веществ в лабораторной и промышленной практике;
- для отбеливания бумаги;
- для очистки масел.
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование);
- для дезинфекции помещений и одежды;
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Существенными достоинствами озонирования, по сравнению с хлорированием, является отсутствие[18] токсинов в обработанной воде (тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например, диоксин) и лучшая, по сравнению с кислородом, растворимость в воде.
По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск его мутагенного, канцерогенного и токсического воздействия перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента[19].
В XXI веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности, необходимых при применении данной техники[источник не указан 2814 дней].
Применение жидкого озона[править | править код]
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике[20]. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см3 соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными[21]. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры и для повышения УИ осталось возможным перейти на новые виды топлива.
Озон в атмосфере[править | править код]
Распределение озона по высоте
Атмосферный (стратосферный) озон является продуктом воздействия солнечного излучения на атмосферный (О2) кислород. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждает растения.
Считается, что молнии Кататумбо являются крупнейшим одиночным генератором тропосферного озона на Земле.
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 Лунин, 1998.
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. ss. 91–100. Auflage. de Gruyter, 1985, S. 460.
- ↑ 1 2 https://www.cdc.gov/niosh/npg/npgd0476.html
- ↑ Takehiko Tanaka; Yonezo Morino. Coriolis interaction and anharmonic potential function of ozone from the microwave spectra in the excited vibrational states // Journal of Molecular Spectroscopy. — 1970. — Vol. 33. — P. 538—551.
- ↑ Kenneth M. Mack; J. S. Muenter. Stark and Zeeman properties of ozone from molecular beam spectroscopy // Journal of Chemical Physics. — 1977. — Vol. 66. — P. 5278—5283.
- ↑ 1 2 3 С. С. Колотов, Д. И. Менделеев. Озон // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ 1 2 Получение озона и его определение — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑
Справочник химика, т. II. Л., «Химия», 1971. - ↑ Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — М.: Химия, 1974.
- ↑ Earth Science FAQ: Where can I find information about the ozone hole and ozone depletion? Архивировано 1 июня 2006 года.
- ↑ Платина не окисляется озоном, но катализирует его разложение.
- ↑ 1 2 Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 44-49
- ↑ Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 439.
- ↑ Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 265
- ↑ Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 259, 269—270
- ↑ National Academy of Sciences: Link Between Ozone Air Pollution and Premature Death Confirmed
- ↑ 1 2 Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест. Гигиенические нормативы 2.1.6.1338-03 (недоступная ссылка). Дата обращения 21 ноября 2012. Архивировано 3 декабря 2013 года.
- ↑ 1 2 Озон — мирное оружие XXI века — Костромской научно-исследовательский институт сельского хозяйства
- ↑ Questionable methods of cancer management: hydrogen peroxide and other ‘hyperoxygenation’ therapies Архивная копия от 7 июля 2010 на Wayback Machine, American Cancer Society
- ↑ Перспективные окислители. (недоступная ссылка). Дата обращения 24 декабря 2009. Архивировано 3 ноября 2009 года.
- ↑ The Dynamics of Unsteady Detonation in Ozone
Литература[править | править код]
- Разумовский С. Д., Заиков Г. Е. Озон и его реакции с органическими соединениями (кинетика и механизм). — М.: Наука, 1974. — 322 с.
- Лунин В. В., Попович М. П., Ткаченко С. Н. Физическая химия озона. — М.: МГУ, 1998. — 480 с. — ISBN 5-211-03719-7.
Ссылки[править | править код]
- Озон — Химическая энциклопедия.
- Озон — не всегда хорошо // Наука и жизнь : журнал. — 1992. — № 8. — С. 155.
Источник


