Венлафаксин при головной боли

Комментарии
Опубликовано в журнале:
«Лечащий врач» май 2008, № 5, с. 1-5
Н. В. Латышева
Е. Г. Филатова, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
Хроническая ежедневная головная боль (ХЕГБ) беспокоит пациентов более 15 дней в месяц на протяжении более трех месяцев. ХЕГБ не является самостоятельной нозологической формой, а представляет синдром, включающий различные первичные и вторичные головные боли (ГБ). Распространенность ХЕГБ в популяции составляет примерно 3–5%, а в специализированных клиниках доля пациентов с ежедневной или почти ежедневной ГБ достигает 70–80%. Заболевание обуславливает значительное снижение качества жизни, нарушает социальную активность пациентов и их трудоспособность, а также представляет собой сложную проблему с точки зрения терапии.
Самыми частыми формами ХЕГБ являются хроническая мигрень (ХМ), хроническая ГБ напряжения (ХГБН) и абузусная ГБ. ХЕГБ в большинстве случаев является осложнением длительно существующей эпизодической ГБ и лишь у немногих пациентов с момента своего дебюта принимает ежедневный или почти ежедневный характер.
Среди факторов хронизации ГБ описаны ожирение, женский пол, исходно частая ГБ (более 1 раза в неделю), чрезмерное употребление анальгетических препаратов (более 10 дней в месяц) и эмоциональный стресс. У более чем половины пациентов с ХЕГБ выявляются нарушения сна и расстройства настроения депрессивного и тревожного характера.
Патогенез ХЕГБ в настоящее время изучен недостаточно. Предполагаются два основных механизма, которые могут лежать в основе хронизации разных форм ГБ — сенситизация ноцицептивных структур и снижение активности антиноцицептивных отделов центральной нервной системы (ЦНС).
При мигрени периферическая сенситизация происходит в сенсорных нейронах, иннервирующих внутримозговые сосуды и оболочки. Центральная сенситизация (ЦС) описана в спинномозговом ядре тройничного нерва, куда стекаются импульсы от мозговых оболочек и кожи лица. Многие пациенты испытывают неприятные ощущения во время и между приступами мигрени при бритье, расчесывании волос, ношении очков и украшений. Ощущение боли при воздействии неболевого раздражителя обозначается как аллодиния, которая в настоящее время часто коррелирует с центральной сенситизацией. Различают статическую (от давления или укола) и динамическую (от поглаживания) аллодинию. При дальнейшем течении некупированного приступа мигрени включаются более центральные отделы ноцицептивной системы. Уже при активации таламуса аллодиния становится двусторонней, ее зона может с головы и лица переходить на руку. При эпизодической мигрени в течение 72 часов включаются антиноцицептивные системы, которые приводят к купированию мигренозного приступа.
Со временем признаки ЦС исчезают не полностью после окончания приступа, и постепенно формируется стабильная ЦС, которая поддерживает боль в хроническом состоянии. При этом нейроны в ЦНС становятся слабо или совсем нечувствительными к периферическим воздействиям. На этом этапе терапевтические воздействия должны быть направлены на усиление нисходящих антиноцицептивных влияний — on/off-нейроны в околоводопроводном сером веществе (ОСВ), антиноцицептивная функция которых нарушена при ХЕГБ.
В настоящее время для профилактики ГБ активно используются антидепрессанты. Показано, что анальгетическое действие трициклических антидепрессантов (ТЦА) не зависит от их антидепрессивного действия и обусловлено их сочетанным серотонинергическим и норадреналинергическим действием. В то же время более безопасные селективные ингибиторы обратного захвата серотонина (СИОЗС) недостаточно эффективны в лечении мигрени и ХГБН [21].
Венлафаксин, структурно новый антидепрессант, по химической структуре отличен от ТЦА, однако также угнетает обратный захват серотонина (5-HT) и норадреналина. Кроме того, по сравнению с амитриптилином препарат действует более специфично на эти рецепторы. Венлафаксин облегчает головную боль так же эффективно, как и ТЦА, но вызывает гораздо меньше побочных эффектов. В ходе двойного слепого исследования профилактического эффекта СИОЗС и венлафаксина при мигрени было показано, что процент пациентов, у которых было достигнуто значительное улучшение в группе венлафаксина, превысил этот показатель в группе СИОЗС.
Эффективность венлафаксина неоднократно доказана в исследованиях пациентов с различными формами нейропатической боли: при диабетической полинейропатии, нейропатии после химиотерапевтического лечения и др. Проведен также ряд исследований профилактического действия венлафаксина при хронической мигрени и ХГБН.
Целью настоящей работы явилось изучение феномена ЦС при ХЕГБ, ее роли в хронификации ГБ и эффективности венлафаксина для ее урежения.
Материал. В исследовании приняли участие 69 пациентов с ХЕГБ и 30 пациентов с эпизодической мигренью (ЭМ) в соответствии с критериями ICHD-2, а также 15 участников группы контроля с ГБ не чаще 1 дн./мес. Группа ХЕГБ была представлена пациентами с ХМ, ХГБН и пациентами со смешанными формами ГБ.
Методы исследования. Всем пациентам была предложена анкета для изучения демографических данных, анамнеза и клинической картины головной боли. Кроме того, пациенты заполняли анкету для изучения симптомов аллодинии.
Статическая аллодиния (СА) исследовалась при помощи альгометра в 5 парах симметричных точек на голове и шее (лоб, висок, темя, задняя поверхность шеи, плечо/трапециевидная мышца).
Порог боли от давления определяется как сила давления, которая необходима для вызывания субъективно неприятного/болезненного ощущения. Использовался ручной альгометр (Commander Algometer™, JTech). В каждой точке выполнялось два последовательных измерения с интервалом в 20 секунд. Для анализа использовалось среднее значение.
СА также измерялась при помощи уколов механическим стимулято ром (Neuropen®, Owen Mumford) с нанесением силы укола в 40 г в тех же точках. Выраженность боли или неприятного ощущения измеря лась по 100-бальной шкале.
Феномен wind-up (временная суммация боли) исследовался при помощи нанесения серии из 10 уколов на участок кожи площадью 1 см2 на лбу, виске и шее стимулятором Neuropen®. Участники исследования оценивали силу единичного укола и всей серии.
Мигательный рефлекс (МР) вызывался при помощи электрической стимуляции правого надглазничного нерва, подаваемой через поверхностные электроды диаметром 5 мм. Катод располагался над наглазничным отверстием, а анод приблизительно на 2 см выше на коже лба. Наносились одиночные электрические стимулы прямоугольной формы длительностью 0,2 мс с произвольными интервалами не менее 30 секунд для минимизации габитуации и регистрировались четкие R1-, R2- и R3-компоненты мигательного рефлекса. В работе анализировались пороги возникновения позднего компонента R3, для которого описан полисинаптический путь, проходящий от ствола головного мозга до спинального ядра тройничного нерва и затем в латеральную ретикулярную формацию.
Ноцицептивный флексорный рефлекс (НФР) регистрировался при стимуляции правого икроножного нерва трендами длительностью 20 мс и частотой 300 Гц с произвольными интервалами не менее 15 секунд. Катод располагался в проекции нерва, а анод на 2 см ниже в области латеральной лодыжки. Референтный электрод располагался над сухожилием двуглавой мышцы бедра, а заземляющий — на середине голени. Регистрировался порог возникновения R3-ответа и порог субъективной болевой чувствительности (когда пациент болевое ощущение оценивал на 5 баллов по 10-бальной шкале ВАШ). Также рассчитывалось соотношение порог боли/порог рефлекса. R3-компонент замыкается через ретикулярную формацию ствола мозга.
Результаты анализировались при помощи компьютерного пакета Statistica (U-тест Манна–Уитни для сравнения групп, корреляционный тест Спирмена, точный тест Фишера для сравнения пропорций, например, распространенности аллодинии). Все показатели приведены в формате Х ± SD.
Результаты исследования
1. Клинические и демографические характеристики пациентов
Группа ХЕГБ была представлена 28 пациентами с ХМ, 31 пациентом с ХГБН и 10 пациентами со смешанными формами ГБ (ХМ или ХГБН в сочетании с цервикогенной ГБ) в соответствии с критериями ICHD-2. В группу вошли 57 женщин и 12 мужчин, средний возраст 40 лет. Средняя частота ГБ составила 25 дн./мес, сила боли 7 баллов. При общей длительности ГБ в анамнезе в 19 лет, наши пациенты страдали ХЕГБ в среднем 6 лет. О злоупотреблении анальгетическими препаратами сообщили 33% пациентов (табл. 1).
Таблица 1
Клинические и демографические характеристики пациентов и контроля
| ХЕГБ | ЭМ | Контроль | |
| Число пациентов | 69 | 30 | 15 |
| Пол, ж:м | 57:12 | 28:2 | 10:5 |
| Возраст, лет | 40,1 ± 12,3 | 37,3 ± 10,5 | 43,1 ± 18,1 |
| Частота ГБ, дн./мес | 25,2 ± 6,0 | 4,7 ± 1,3 | |
| Сила боли, ВАШ | 7,1 ± 1,9 | 7,7 ± 1,2 | |
| Длительность ГБ, лет | 18,2 ± 12,7 | 16,3 ± 9,7 | |
| Длительность ХЕГБ, лет | 5,7 ± 7,0 | – | |
| ХМ:ХГБН:Смеш. | 28:31:10 | – | |
| Абузус | 20 (33%) | 1 | |
| Кожная аллодиния (анкета) | 79% | 46% | |
| Сила боли во время исследования, ВАШ | 2,3 ± 1,9 |
По данным анкеты аллодинии, в группе ХЕГБ распространенность ЦС во время интенсивной ГБ составила 79%.
2. Статическая аллодиния, феномен wind-up и порог R3 МР и НФР у пациентов с ХЕГБ
Чувствительность к боли от давления достоверно выше в группе ХЕГБ во всех точках, кроме висков, к боли от укола и wind-up во всех точках, кроме лба, по сравнению с группой контроля.
Для удобства расчетов использовался индекс альгометрии. Это сумма порогов боли от давления во всех точках. Так как нет данных о том, какой порог боли от давления указывает на аллодинию, мы использовали группу контроля для получения нормативных данных. Об аллодинии свидетельствует индекс, выше которого указали свои пороги 95% участников группы контроля (в нашем исследовании пороговый индекс альгометрии составил 41,9 фунта). Таким образом, распространенность ЦС во время наименьшей боли в группе ХЕГБ составила 70%. Группа ХЕГБ достоверно отличалась от контроля по индексу альгометрии.
Более того, отсутствие различий в болевых порогах справа и слева, независимо от преимущественной стороны боли при ее усилениях, говорит о стабильности ЦС, так как в приступе мигрени аллодиния всегда развивается на стороне боли и переходит на противоположную сторону, шею и плечи только при длительных приступах.
Для определения нормативных данных порога R3 МР это исследование было проведено на 15 участниках группы контроля. По нашим данным, порог R3-компонента составил 9,6 ± 1,5 мА. В группе ХЕГБ выявлено достоверное снижение порога R3 мигательного рефлекса (7,6 ± 2,16 мА). Нормативный порог НФР составил 10,3 ± 1,7 мА, порог боли 9,8 ± 1,8 мА. В группе ХЕГБ выявлено достоверное снижение порога НФР (9,0 ± 2,2 мА) и порога боли (6,2 ± 1, мА).
3. Статическая аллодиния, феномен wind-up в группе сравнения с ЭМ
Для изучения закономерностей развития ЦС и ее влияния на хронизацию ГБ была исследована группа пациентов с ЭМ с частотой ГБ более 2 дн./мес и менее 15 дн./мес. Возраст пациентов, длительность заболевания и сила боли не отличались в группах ЭМ и ХЕГБ. Средняя частота приступов составила 5,2 дн./мес.
У пациентов группы ЭМ выявлены достоверно более высокие пороги боли от давления и укола во всех точках по сравнению с группой ХЕГБ. Пороги боли при ЭМ достоверно не отличались от показателей контрольной группы испытуемых, что свидетельствует об отсутствии СА при эпизодической мигрени в межприступном периоде. Средний индекс wind-up, напротив, достоверно не различался при ЭМ и ХЕГБ.
Таким образом, группа ЭМ отличается от контроля только по индексу wind-up и от ХЕГБ по остальным показателям сенситизации.
Пациентов с ЭМ можно разделить на 2 подгруппы по индексу wind-up: с высоким и низким индексом. Точка раздела была определена аналогично точке раздела для альгометрии и составила 14,1. В подгруппе с более высоким wind-up выявлена более высокая частота приступов (7,5 дн./мес vs. 3,5 дн./мес) и меньшая длительность заболевания (12,1 года vs. 19,1 года). В подгруппе пациентов, указывающих на признаки кожной аллодинии в анамнезе, выявлена большая частота приступов.
4. Терапия венлафаксином
В качестве профилактического лечения головной боли 18 пациентам из вышеописанной группы пациентов с ХЕГБ был назначен прием венлафаксина (Велафакс®) курсом продолжительностью 1,5 месяца. Схема дозирования: 37,5 мг (18,9 мг × 2 раза в сутки) в течение 7 дней с последующим повышением до 75 мг (37,5 мг × 2 раза в сутки).
5 пациентов (28%) закончили исследование преждевременно: 3 пациента (17%) из-за побочных эффектов, развившихся на стадии титрования препарата и помешавших поднять дозу до минимальной терапевтической; 2 пациента (11%) — из-за отсутствия эффекта от лечения. 13 пациентов прошли полный курс лечения и были включены в анализ. Им также было проведено повторное обследование (аналогичное описанному выше) после окончания 6-недельного курса лечения.
По результатам лечения было достигнуто достоверное снижение средней силы боли (с 6,6 до 4 баллов) и ее частоты (с 26 до 12 дн./мес). У 10 пациентов (77%) частота боли снизилась достоверно, а 54% пациентов отметили как минимум 50%-ное урежение ГБ. У 70% пациентов было достигнуто урежение ГБ более чем на 10 дн./мес (табл. 2).
Таблица 2
Результаты лечения венлафаксином
| До лечения | После лечения | р | |
| Сила боли, ВАШ | 6,6 ± 1,1 | 4,0 ± 2,0 | 0,0005* |
| Частота ГБ | 26,0 ± 4,7 | 12,0 ± 10,7 | 0,0001* |
| Количество анальгетиков | 21,8 ± 22,7 | 5,1 ± 9,3 | 0,005* |
| Индекс альгометрии | 40,6 ± 12,8 | 53,8 ± 13,1 | 0,0003* |
| Индекс боли от укола | 48,2 ± 49,8 | 25,3 ± 42,2 | 0,117 |
| Индекс wind-up | |||
| Аллодиния | 3,7 ± 1,6 | 1,1 ± 1,2 | 0,003* |
| МР R3 | 7,3 ± 1,9 | 9,2 ± 3,0 | 0,023* |
| НФР порог боли | 6,6 ± 4,13 | 7,6 ± 2,6 | 0,100 |
| НФР порог рефлекса | |||
| НФР боль/рефлекс | 0,57 ± 0,2 | 0,8 ± 0,2 | 0,002* |
* достоверные различия.
Заметное снижение частоты и интенсивности ГБ позволило пациентам сократить количество принимаемых анальгетиков (с 21,8 до 5,1 таблетки в месяц), что значительно снижает риск развития абузусной ГБ.
Кроме того, в ходе лечения было достигнуто достоверное повышение индекса альгометрии до нормальных значений и уменьшение выраженности и распространенности аллодинии. У 54% пациентов клинические признаки аллодинии исчезли полностью.
По данным нейрофизиологических исследований, порог R3 МР достоверно повысился и достиг нормального диапазона значений (с 7,3 до 9,2 мА). Пороги боли и рефлекса НФР, а также соотношение порог боли/порог рефлекса также имели тенденцию к повышению, но не достигли нормальных значений.
78% пациентов указали на наличие побочных эффектов в ходе лечения. Наиболее частыми среди них были: тошнота, урежение стула, нарушение концентрации внимания, снижение аппетита. У большинства пациентов эти эффекты были легкими и быстро проходящими. Они развивались в большинстве случаев в течение первой недели приема (на субтерапевтической дозе в 37,5 мг) и исчезали в среднем через 5–7 дней, что не препятствовало повышению дозы до терапевтической.
Обсуждение
В группе пациентов с ХЕГБ выявлена сенситизация центральных ноцицетивных структур — статическая аллодиния, которая сохраняется даже в период наименьшей боли или ее отсутствия. В то же время при ЭМ у большинства пациентов в межприступном периоде аллодиния отсутствует. Однако в группе ЭМ выявляются также пациенты с повышенным индексом wind-up, т. е. те, у кого признаки сенситизации проявляются даже в межприступном периоде. У таких пациентов отмечена более высокая частота приступов и меньшая длительность заболевания. Можно сделать вывод о том, что со временем элементы ЦС не полностью исчезают после окончания мигренозного приступа и пациент становится более восприимчивым к следующему приступу, т. е. встает на путь хронизации ГБ. После того как боль приобретает ежедневный или почти ежедневный характер, она существует самостоятельно, независимо от наличия или отсутствия провоцирующих факторов, и поддерживается в результате центральной сенситизации ноцицептивных структур.
Более низкая длительность ЭМ в подгруппе с высоким wind-up говорит о том, что сам фактор длительности заболевания не приводит к хронизации ГБ. Из клинического опыта известно, что некоторые пациенты могут в течение многих лет страдать ЭМ с неизменной частотой приступов. У другой части пациентов частота приступов начинает неуклонно нарастать вскоре после дебюта заболевания. Таким образом, измерение феномена wind-up позволяет выделить пациентов, у которых началась динамика ЭМ в направлении хронизации и трансформации ГБ.
По нашим данным, пациентов с ГБ можно разделить на несколько стадий вне зависимости от диагноза по критериям ICHD-2 (рисунок):
- эпизодическая ГБ с признаками аллодинии только во время приступа;
- эпизодическая ГБ, при которой повышение wind-up сохраняется между приступами;
- ХЕГБ со стабильными признаками ЦС во время усилений боли, фоновой ГБ и безболевом периоде.
Рисунок. Стадии развития ГБ
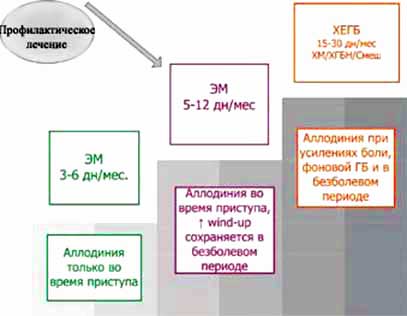
Выявление ЦС с помощью простого метода wind-up у пациентов с эпизодической ГБ в межприступном периоде позволяет выделить группу риска, уже вступившую на путь хронизации ГБ, и является показанием к началу профилактического лечения.
В ходе исследования было показано, что венлафаксин является эффективным и безопасным средством для урежения ГБ. Профилактическое лечение Велафаксом приводит к выраженному клиническому облегчению состояния пациентов, сокращению приема анальгетиков. Позитивный эффект препарата подтверждается уменьшением выраженности аллодинии, а также нормализацией порога болевого R3-компонента мигательного рефлекса, который отражает функциональное состояние стволовых структур и спинномозгового ядра тройничного нерва, участвующих в поддержании ЦС.
По вопросам литературы обращайтесь в редакцию.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Головная боль (ГБ) является одной из наиболее частых жалоб пациентов на приеме у врача. Постоянной или хронической ежедневной ГБ страдают 3-5% популяции [10]. Такая боль значительно снижает качество жизни, нарушает социальную активность и трудоспособность пациентов [12].
В современной классификации ГБ выделяются первичные и вторичные ГБ [14]. При первичных ГБ, сама боль и связанные с ней симптомы составляют ядро клинической картины, а при вторичных — она является симптомом другого заболевания [7]. Подавляющее большинство первичных ГБ составляют мигрень и ГБ напряжения (ГБН). В настоящее время определены и сформулированы критерии диагностики первичных ГБ, в значительной степени изучены механизмы их возникновения. Считается, что в основе патогенеза хронических ГБН лежат 2 основных механизма — сенситизация ноцицептивных структур и снижение активности антиноцицептивных отделов ЦНС [5]. Среди факторов, способствующих развитию ГБН, большое значение придается эмоциональным нарушениям и мышечному напряжению [3, 7].
Хотя психогенный фактор играет важную роль в патогенезе всех первичных ГБ, тем не менее отдельно выделяют категорию «психогенных ГБ», т.е. вторичных ГБ, при которых психический фактор определяет этиологию заболевания. В соответствии с Международной классификацией боли [18] и классификацией головных болей [14], к «психогенным болям» в строгом смысле этого слова относят ГБ, наблюдающиеся в рамках истерических расстройств. В МКБ-10 они отнесены к «соматоформным расстройствам» (рубрика «вторичные головные боли, связанные с первичным психическим заболеванием»). Частота ГБ при истерии составляет около 60% [15], а при истерических расстройствах в соматической сфере, которые обозначены в МКБ-10 как «расстройства соматизации», ГБ даже входят в критерии диагностики. В то же время в Международной классификации головных болей подчеркивается, что «характеристики этой головной боли остаются неясными» [14]. Учитывая, что риск развития «расстройств соматизации» в течение жизни в популяции составляет около 2%, становится очевидным, что изучение клинических особенностей психогенных ГБ (ПГБ) представляет большой практический интерес.
Для лечения хронических ГБН активно используются антидепрессанты, в частности трициклические (ТЦА), анальгетическое действие которых обусловлено сочетанным серотонинергическим и норадреналинергическим влиянием и при этом не зависит от их антидепрессивного эффекта [16].
Данных в отношении эффективности терапии антидепрессантами ПГБ значительно меньше. D. Fishbain и соавт. [13] в 1998 г. провели мета-анализ 155 рандомизированных плацебо-контролируемых исследований эффективности антидепрессантов при психогенных болевых синдромах различной локализации. Результаты анализа 11 из этих работ показали, что у такой категории больных антидепрессанты (в основном ТЦА) снижают интенсивность боли достоверно больше, чем плацебо. В другом исследовании [15] показано, что в случае преобладания болевых синдромов в рамках истерии врачи значительно чаще назначают антидепрессивные препараты по сравнению с теми случаями истерий, где ведущими являются функциональные неврологические симптомы. Однако эффективность лечения антидепрессантами психогенных болей в этом исследовании не оценивалась.
В настоящее время в качестве антидепрессантов с доказанным противоболевым эффектом используются препараты группы селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) — дулоксетин, венлафаксин, милнаципран. Венлафаксин является безопасным антидепрессантом, по химической структуре отличным от ТЦА, однако он также эффективно, как и ТЦА, ингибирует обратный захват 5-HT и норадреналина. В ряде исследований [8, 19] показана эффективность венлафаксина при хронической мигрени и ГБН. Целенаправленных исследований эффективности антидепрессантов в отношении ПГБ в литературе мы не обнаружили.
Целью настоящей работы явился сравнительный клинико-психологический анализ больных с хроническими вариантами ГБН и ПГБ и оценка эффективности терапии препаратом из группы СИОЗСН венлафаксином XR (велаксин, «Egis», Венгрия).
Наблюдали 41 пациента, у которых ведущим симптомом была хроническая ГБ. В соответствии с критериями Международной классификации головных болей, у 23 больных были диагностированы хронические ГБН, а у 18 — ПГБ. В обеих группах преобладали женщины. По возрасту и длительности заболевания больные обеих групп достоверно не отличались.
Исследование проводилось в 2 этапа. На первом этапе 12 пациентов с ГБН и 11 с ПГБ сравнивались по клиническим и психометрическим показателям. На втором этапе у другой группы больных, состоящей из 11 пациентов с ГБН и 7 ПГБ, оценивалась эффективность 2-месячной терапии велаксином.
Все больные находились на амбулаторном обследовании в Отделе патологии вегетативной нервной системы Московской медицинской академии им. И.М. Сеченова, а также на амбулаторном или стационарном обследовании в Городском центре вегетологии при московской городской клинической больнице №33 им. А.А. Остроумова.
Было проведено комплексное исследование болевого синдрома. В клиническом интервью врач оценивал социо-демографические данные, клиническую картину ГБ, данные анамнеза.
Интенсивность ГБ оценивалась с помощью 10-балльной визуальной аналоговой шкалы (ВАШ).
С целью качественной оценки характера боли применялся Мак-Гилловский болевой опросник [1] в модифицированном варианте. В предлагаемом опроснике боль характеризуется с помощью 78 слов-дескрипторов, разделенных на 20 подклассов. В каждом подклассе слова размещаются по нарастанию интенсивности передаваемого ими болевого ощущения. Каждое слово имеет числовой показатель, соответствующий порядковому номеру слова в подклассе (ранг дескриптора). Пациент должен дать описание своей боли, подчеркнув те или иные ее характеристики в любом из 20 подклассов. В отличие от стандартного варианта заполнения опросника, где больному предлагалось отметить только одно слово, в нашем варианте больному разрешалось отметить все возможные варианты боли в каждом из 20 пунктов. В последующем анализировались общее количество выбранных дескрипторов, сумма рангов всех выбранных дескрипторов, сумма максимальных рангов выбранных дескрипторов и интенсивность боли (по 5-балльной шкале).
Исследование эмоционально-личностных особенностей проводили с использованием методики многостороннего исследования личности (ММИЛ) [2]; оценки уровня реактивной и личностной тревожности — с помощью опросника Спилбергера [6]; выявление степени выраженности депрессии — с помощью опросника Бека [9].
Нейрофизиологическую характеристику боли получали при исследовании ноцицептивного флексорного рефлекса (НФР) [3]. Использовался тренд из 10 стимулов частотой 200 Гц, длительность каждого стимула 1 мс. Определялись следующие показатели: порог болевого ощущения, т.е. порог боли (ПБ) и порог рефлекса (ПР), а также рассчитывали коэффициент НФР — соотношение ПБ/ПР.
Для лечения головной боли 18 пациентам (11 с ГБН и 7 с ПГБ) был назначен курсовой прием велаксина в течение 2 мес. Доза препарата титровалась с применением таблеток по схеме: 18,75 мг 1 раз в день в течение 3 дней, затем 37,5 мг 1 раз в день в течение 3 дней, далее назначались капсулы 75 мг 1 раз в день в течение 2 мес. На начальном этапе разрешалось применение неопиоидных анальгетиков для кратковременного облегчения боли и седативных препаратов растительного происхождения для уменьшения тревоги.
До начала терапии велаксином проводилось фоновое клинико-неврологическое, психометрическое и нейрофизиологическое исследование, затем следовала 2-месячная терапия велаксином и после ее окончания — оценка эффективности лечения по отчету больных и данным повторного психометрического и нейрофизиологического исследования. Оценка собственно эффективности лечения после терапии осуществлялась по следующим показателям: субъективная оценка больным общей эффективности лечения (по 100-балльной шкале); оценка больным динамики интенсивности ГБ (по 10-балльной шкале ВАШ); косвенная оценка эффективности лечения по динамике абузусного фактора и других (неболевых) симптомов; анализ динамики психометрических показателей и показателей НФР.
Статистическая оценка полученных данных проводилась при помощи компьютерного пакета STATISTICA 6.
При сравнении ГБН и ПГБ по таким показателям, как локализация боли, ее характер и провоцирующие факторы, достоверных различий выявлено не было. Соответствующие группы больных не отличались по возрасту, длительности болезни, возрасту пациентов к периоду дебюта ГБ и факторам, способствующим дебюту и экзацербации ГБ. В обеих группах ведущими причинами и факторами, поддерживающими ГБ, являлись стрессовые события и психотравмирующие ситуации (смерть близких, конфликты в семье и на службе и др.). Кроме того, у пациентов обеих групп отмечались высокая метеочувствительность и усиление ГБ при эмоциональном напряжении.
При клиническом обследовании у пациентов с ПГБ были выявлены следующие особенности, не обнаруженные ни у одного больного из группы ГБН: 1) помимо ГБ в клинической картине наблюдались полиморфные функциональные неврологические симптомы — психогенные парезы, мутизм, псевдогемиспазм, припадки, дизбазии и др.; 2) ГБ входили в структуру психогенного припадка; 3) помимо ГБ отмечались болевые симптомы другой локализации с интенсивностью боли до 10 баллов по ВАШ; 4) латерализация ГБ сочеталась с болевым синдромом по гемитипу и психогенной слабостью в этой же половине тела. Перечисленные особенности в различных сочетаниях имелись у каждого пациента с ПГБ.
Таким образом, ПГБ представляет собой специфический симптомокомплекс, включающий, помимо собственно ГБ, интенсивные боли в других областях тела, связь ГБ с функциональным неврологическим дефектом как по времени возникновения, так и по латерализации.
Основным методом количественного анализа болевого синдрома в выделенных группах в данном исследовании явился болевой опросник Мак-Гилла, результаты которого приведены в табл. 1.
Как следует из приведенной таблицы, интенсивность фоновой боли по ВАШ и большинство показателей болевого опросника Мак-Гилла у больных с ПГБ оказались достоверно выше по сравнению с пациентами с ГБН. Таким образом, больные с ПГБ оценивают свою боль как более сильную и описывают ее как более аффективно насыщенную и дезадаптирующую, чем больные с ГБН.
Показатели актуальной и личностной тревоги по тесту Спилбергера и показатели по тесту Бека в обеих группах не выходили за пределы нормы и не имели существенных межгрупповых различий.
На рис. 1 представлены усредненные профили ММИЛ обеих групп больных. Рисунок 1. Усредненные профили ММИЛ у пациентов с ГБН и ПГБ. По оси ординат — баллы; по оси абсцисс — шкалы ММИЛ — L, F, K — дополнительные шкалы, направленные на оценку корректности опросника, основные шкалы: 1 — ипохондрии, 2 — депрессии, 3 — истерии, 4 — психопатии, 5 — мужественности — женственности, 6 — паранойи, 7 — психостении, 8 — шизофрении, 9 — гипомании, 10 — социальной инверсии. Достоверность различий между ГБН и ПГБ: * — p<0,05; ** — p<0,01; *** — p<0,005; **** — p<0,001. Из него следует, что профиль ММИЛ больных с ПГБ существенно превышал уровень нормы (70-Т-баллы) по шкалам ипохондрии (1-я шкала), истерии (3- шкала) и своеобразного модуса поведения (8-я шкала)[1]. Подобный профиль описывается в литературе [4, 11] как типичный для истерии. Профиль больных с ГБН не отличался от психологической нормы, но имел достоверные различия с профилем больных с ПГБ по высоте оценочных шкал (L, F) и клинических шкал (1, 3, 6, 7, 8).
Рисунок 1. Усредненные профили ММИЛ у пациентов с ГБН и ПГБ. По оси ординат — баллы; по оси абсцисс — шкалы ММИЛ — L, F, K — дополнительные шкалы, направленные на оценку корректности опросника, основные шкалы: 1 — ипохондрии, 2 — депрессии, 3 — истерии, 4 — психопатии, 5 — мужественности — женственности, 6 — паранойи, 7 — психостении, 8 — шизофрении, 9 — гипомании, 10 — социальной инверсии. Достоверность различий между ГБН и ПГБ: * — p<0,05; ** — p<0,01; *** — p<0,005; **** — p<0,001. Из него следует, что профиль ММИЛ больных с ПГБ существенно превышал уровень нормы (70-Т-баллы) по шкалам ипохондрии (1-я шкала), истерии (3- шкала) и своеобразного модуса поведения (8-я шкала)[1]. Подобный профиль описывается в литературе [4, 11] как типичный для истерии. Профиль больных с ГБН не отличался от психологической нормы, но имел достоверные различия с профилем больных с ПГБ по высоте оценочных шкал (L, F) и клинических шкал (1, 3, 6, 7, 8).
Корреляционный анализ показателей Мак-Гилловского теста и личностных характеристик больных представлен в табл. 2.
Как видно из приведенной таблицы, у пациентов с ГБН выявлены множественные достоверные и положительные корреляции показателей Мак-Гилловского теста с высотой 1, 3, 6 и 9 шкал профиля ММИЛ, а также отрицательные корреляции с оценочной шкалой коррекции (шкала K). У больных с ПГБ показатели Мак-Гилловского теста практически не коррелирует с высотой шкал профиля ММИЛ, за исключением положительной корреляции с показателем «лживости» (шкала L).
Результаты лечения велаксином. Из 18 больных, начавших лечение этим препаратом, ни один не отменил лечение из-за побочных эффектов. У одной больной на фоне приема препарата возникли головокружения, подъем АД до 140/90 мм рт.ст., тошнота, однако при уменьшении дозы побочные явления регрессировали и больная в полном объеме закончила 2-месячный курс лечения.
При анализе отчета больных об общей эффективности терапии по 100-балльной шкале было обнаружено, что больные с ГБН посчитали, что их состояние улучшилось на 72%, в то время как больные с ПГБ оценили улучшение только на 35%. При анализе динамики интенсивности ГБ выявилось, что больные с ПГБ, которые оценивали свою ГБ по ВАШ как более сильную в сравнении с больными ГБН (9,2 и 7 баллов соответственно), после терапии сообщили и о более выраженном ее снижении (3,2 и 2,5 баллов соответственно) (рис. 2). Рисунок 2. Динамика интенсивности боли при терапии велаксином у больных с ГБН и ПГБ по 10-балльной ВАШ. Здесь и на рис. 3 темные столбцы до лечения, светлые — после лечения. По оси ординат — баллы. Касаясь ассоциированных с ГБ симптомов (слабость, головокружение, нервозность, тревожность, инсомния), больные обеих групп в первую очередь отмечали исчезновение слабости, усталости (в среднем на 60%).
Рисунок 2. Динамика интенсивности боли при терапии велаксином у больных с ГБН и ПГБ по 10-балльной ВАШ. Здесь и на рис. 3 темные столбцы до лечения, светлые — после лечения. По оси ординат — баллы. Касаясь ассоциированных с ГБ симптомов (слабость, головокружение, нервозность, тревожность, инсомния), больные обеих групп в первую очередь отмечали исчезновение слабости, усталости (в среднем на 60%).
Косвенным показателем эффективности проводимой терапии служит уменьшение лекарственного абузуса, т.е. количества таблеток в месяц, принимаемых больным для облегчения ГБ. На рис. 3 показаны значения этого показателя до и после лечения. Рисунок 3. Динамика выраженности абузусного фактора при лечении велаксином у больных с ГБН и ПГБ. По оси ординат — количество принимаемых больными таблеток анальгетиков в месяц. Как видно из рисунка, до лечения в группе больных с ПГБ абузусный фактор был существенно и достоверно выше, чем в группе пациентов с ГБН (130,5 и 32,5 соответственно), однако после терапии велаксином в обеих группах отмечено его существенное и достоверное снижение (4,5 и 2,2 соответственно), что позволяет, с одной стороны, объективизировать результаты терапии, а с другой — свидетельствует об очевидной эффективности велаксина не только при ГБН, но и при ПГБ.
Рисунок 3. Динамика выраженности абузусного фактора при лечении велаксином у больных с ГБН и ПГБ. По оси ординат — количество принимаемых больными таблеток анальгетиков в месяц. Как видно из рисунка, до лечения в группе больных с ПГБ абузусный фактор был существенно и достоверно выше, чем в группе пациентов с ГБН (130,5 и 32,5 соответственно), однако после терапии велаксином в обеих группах отмечено его существенное и достоверное снижение (4,5 и 2,2 соответственно), что позволяет, с одной стороны, объективизировать результаты терапии, а с другой — свидетельствует об очевидной эффективности велаксина не только при ГБН, но и при ПГБ.
Не было получено существенного изменения показателей тревоги и депрессии в связи с лечением.
При анализе порогов боли и порогов рефлекса не было получено существенных различий между группами как в фоне, так и в динамике. Достоверные различия в фоне были обнаружены между НФР-коэффициентом боль/ рефлекс, который в группе ГБН был существенно снижен (0,47) и практически не изменен в группе ПГБ (0,87) (p<0,05). После проведенного лечения в обеих группах этот показатель увеличился (до 0,8 и 1,0 соответственно), что свидетельствует о нормализации активности антиноцицептивных систем и коррелирует с клиническим улучшением состояния больных.
J. Loeser [17] в 1980 г. предлагал рассматривать боль как многокомпонентный феномен и выделял в нем следующие уровни: 1) ноцицептивный (раздражение болевых рецепторов), 2) сенсорный (уровень восприятия или ощущения), 3) переживание (боли), 4) болевое поведение. В настоящем исследовании мы попытались оценить уровень восприятия и переживания боли, а также оценить болевое поведение в группах пациентов с хронической ГБН и ПГБ. Проведенное исследование показало, что по таким характеристикам, как характер, локализация, частота и провоцирующие факторы, ГБН достоверно не отличается от ПГБ. В то же время больные с ПГБ в сравнении с пациентами с ГБН достоверно выше оценивают интенсивность ГБ по ВАШ, переживают ее, как более сильную, неприятную и дестабилизирующую (по данным Мак-Гилловского опросника). Профиль ММИЛ у больных с ПГБ существенно отличается от профиля больных с ГБН как по конфигурации, так и по высоте профиля кривой, что свидетельствует о наличии более выраженных эмоционально-личностных отклонений у больных с ПГБ. При этом у больных с ГБН выявлены существенно более тесные корреляционные связи между показателями интенсивности боли (Мак-Гилловский опросник) и высотой шкал профиля ММИЛ, и отсутствие таких связей у больных с ПГБ. Можно предположить, что у больных с ГБН переживание боли соответствует ее интенсивности, в то время как у больных с ПГБ эмоционально-поведенческие паттерны в значительно меньшей степени соотносятся с болевыми ощущениями, что приводит к гротескной и утрированной форме предъявления симптома.
Курс терапии велаксином в дозе 75 мг в сутки в течение 2 мес оказал положительное влияние на самочувствие пациентов обеих групп. Значительно уменьшилась интенсивность и частота ГБ, снизилось количество принимаемых обезболивающих препаратов, уменьшились ассоциированные с ГБ симптомы и наросла активность. Клиническому улучшению соответствовала и нормализация нейрофизиологических параметров. Следует отметить, что больные с ПГБ первоначально оценили эффективность лечения велаксином как низкую, и только дифференцированный анализ по отдельным показателям выявил значительный анальгетический эффект препарата в ?


