Клинические исследования при мигрени

Мигрень – частая форма первичной головной боли, которая значительно ухудшает качество жизни молодых трудоспособных пациентов. Распространенность мигрени в странах Европы и США в среднем составляет 14%, значительно чаще мигрень встречается у женщин [1]. Для мигрени характерна интенсивная, приступообразная, чаще односторонняя головная боль длительностью от 4 до 72 ч, усиливающаяся при физической активности и сопровождающаяся различными неврологическими, соматическими, эмоционально-аффективными и вегетативными проявлениями. Существуют 2 формы мигрени: мигрень без ауры и мигрень с аурой [2].
У большинства пациентов мигрень имеет наследственный характер, но среди основных механизмов также обсуждаются нейрохимические и нейрогенные факторы. Показано также, что для пациентов с мигренью характерна повышенная возбудимость нейронов коры головного мозга. Важным механизмом, запускающим приступ и обусловливающим развитие и сохранение боли, является активация тригемино-васкулярной системы (ТВС). Механизм мигренозной ауры связывают с распространением волны возбуждения корковых нейронов (распространяющаяся корковая депрессия) от зрительной коры к соматосенсорной и лобно-височной области. Распространяющаяся корковая депрессия определяет характер и последовательность симптомов ауры: зрительных, чувствительных, речевых [3].
Большинство приступов мигрени возникают внезапно. Но часто приступ может провоцироваться рядом эндогенных и экзогенных факторов (триггеров мигрени). Многие авторы полагают, что для запуска приступа мигрени необходимо сочетание нескольких триггеров. В настоящее время описано около 60 различных факторов, провоцирующих приступы мигрени [4].
Основные факторы, провоцирующие приступ мигрени:
– психофизиологические: чрезмерная нагрузка, усталость, плохой или избыточный сон;
– гормональные и соматические: менструация, применение оральных контрацептивов, высокое кровяное давление;
– эмоциональные: тревога, депрессия, выраженный стресс;
– диетические: нерегулярное питание, алкоголь, шоколад, сыр, цитрусовые и др.;
– экзогенные: изменение погоды и климата, яркий свет, шум, сильные запахи, курение, горячая ванна.
Диагностика мигрени – клиническая, т. е. она основывается на детальном клиническом опросе и осмотре пациента. Крайне важны информация о возрасте начала головной боли, семейный анамнез, характеристики приступа, провоцирующие и облегчающие факторы, отсутствие признаков вторичного характера головной боли. При установлении диагноза следует опираться на диагностические критерии Международной классификации головных болей МКГБ-3 бета [2].
При типичной клинической картине мигрени дополнительные исследования не показаны, поскольку они неинформативны. Параклинические исследования должны проводиться только при подозрении относительно симптоматического характера цефалгии.
Основные стратегии купирования приступа мигрени
Главные цели лечения мигрени – облегчение течения мигрени, предотвращение хронизации и улучшение качества жизни пациента. Для достижения вышеперечисленных целей необходимо соблюдение нескольких подходов [5]:
1) купирование приступов мигрени;
2) профилактическое лечение;
3) рекомендации по соблюдению стиля жизни и поведенческая терапия.
Профилактическая терапия мигрени проводится пациентам в случае наличия соответствующих показаний (частые приступы головной боли, высокая степень дезадаптации пациента, полная неэффективность симптоматических средств и др.). В целом от 10 до 30% пациентов нуждаются в назначении превентивных средств для снижения частоты приступов. Между тем стратегия купирования приступов должна быть применима у каждого пациента, обратившегося за консультацией, поскольку тяжесть мигренозной цефалгии, как правило, требует лекарственного купирования, причем подавляющее большинство пациентов лекарственные средства используют при каждом приступе мигрени.
Цели купирования приступа мигрени – уменьшение интенсивности, длительности боли и сопровождающих симптомов (тошнота, рвота, фоно- и фотофобии и т. д.) и нормализация общего состояния пациента. Выбор оптимального средства для купирования приступа мигрени среди существующего множества фармакологических средств является непростым для каждого пациента.
Фармакологические средства, применяемые для купирования приступа мигрени:
• Препараты с неспецифическим механизмом действия:
– анальгетики (парацетамол, кодеин);
– нестероидные противовоспалительные средства;
– комбинированные препараты.
• Специфические антимигренозные средства:
– селективные агонисты 5-HT1В/1D-рецепторов (триптаны);
– неселективные агонисты 5-HT1-рецепторов (эрготамин, дигидроэрготамин).
При выборе конкретного препарата для купирования приступа следует учитывать индивидуальные характеристики пациента, такие как интенсивность головной боли, скорость ее нарастания, наличие ассоциированных симптомов, степень дезадаптации, предшествующий опыт и предпочтения пациента. С этой точки зрения используется стратифицированный подход, который предполагает учет наиболее важной характеристики приступа мигрени – уровня дезадаптации пациента. Этот подход основывается на ранжировании мигренозных приступов по тяжести и степени нарушения адаптации пациентов [6]. Пациентам с легкими приступами и хорошим уровнем адаптации назначаются простые анальгетики и НПВС, возможно, в комбинации с лекарствами, которые улучшают их абсорбцию. Пациентам с тяжелыми и умеренными приступами необходимо назначение триптанов.
Также важным принципом купирования приступа мигрени является раннее назначение антимигренозного препарата, обеспечивающее более полный обезболивающий эффект и меньшую вероятность рецидива. Кроме того, по мере прогрессирования приступа у большинства пациентов развивается гастропарез с нарушением пассажа пер-оральных медикаментозных препаратов в кишечник и их плохой абсорбцией. Раннее применение антимигренозных средств важно и с этой точки зрения [7].
Триптаны создавались специально для лечения приступа мигрени. Они обладают высоким аффинитетом к 5-HT1D и 5-HT1В-рецепторам, и у них отсутствует активность по отношению к адренергическим, дофаминергическим, мускариновым, гистаминовым и серотониновым рецепторам других подтипов.
В настоящее время известны 7 представителей класса триптанов, в России зарегистрированы 5 из них (табл. 1) [8]. 
Патофизиологические механизмы действия триптанов при мигрени:
– сужение избыточно расширенных краниальных сосудов;
– ингибирование выделения противовоспалительных и вазоактивных пептидов;
– ингибирование трансмиссии боли на уровне ствола мозга.
Несмотря на то, что все препараты относятся к одному классу, они имеют различные фармакокинетические параметры. Эти различия имеют большое клиническое значение как факторы, определяющие эффективность триптана.
В 1990 г. в клиническую практику был внедрен суматриптан. Он был первым представителем класса триптанов. В клинических исследованиях и до настоящего времени суматриптан рассматривается как «золотой стандарт» специфического лечения приступов мигрени. В последующем в практику вошли препараты с более высокой биодоступностью, достаточно длинным периодом полувыведения, что позволяет избегать частого приема препарата и рецидива головной боли.
Сравнительный анализ триптанов для купирования приступа мигрени
В исследовании J. Pascual et al. был проведен анализ использования золмитриптана в дозировке 5 мг для купирования приступа мигрени. Были исследованы 82 пациента, которые купировали в среднем 7 приступов мигрени. Пациенты принимали золмитриптан орально и интраназально, и также суматриптан подкожно. Авторами был сделан вывод о том, что около 62,5% пациентов отдавали свое предпочтение золмитриптану в связи с его хорошей эффективностью [9].
В 2015 г. было проведено подобное исследование, авторы которого пришли к выводу о том, что стандартная доза триптанов уменьшала интенсивность головной боли в течение 2 ч у 42–76% пациентов. Среди триптанов лучшую эффективность показали подкожная форма суматриптана и таблетированные формы золмитриптана и элетриптана [10].
Эффективность золмитриптана для купирования острого приступа мигрени была показана в исследовании L.C. Chen et al. Авторы продемонстрировали, что золмитриптан в дозировке 2,5 мг имел такую же эффективность при острых приступах мигрени, как элетриптан 2,5 мг и суматриптан 50 мг. Также золмитриптан был более эффективен, чем наратриптан 2,5 мг [11].
Золмитриптан является селективным агонистом 5НТ1-рецепторов. Обладает высоким сродством по отношению к 5НТ1B/1D-рецепторам и умеренным аффинитетом к 5HT1A-рецепторам. Взаимодействуя с 5НТ-рецепторами интракраниальных сосудов (включая артериовенозные анастомозы) и чувствительных нервов ТВС, иннервирующих чувствительные к боли интракраниальные структуры, золмитриптан вызывает вазоконстрикцию, ассоциированную с подавлением высвобождения CGRP, VIP и субстанции Р, и облегчает течение приступа мигрени, снижая интенсивность боли не позднее чем через 1 ч после приема, уменьшая выраженность тошноты, рвоты, фото- и фонофобии. Взаимодействие золмитриптана с рецепторами по механизму отрицательной обратной связи способствует уменьшению высвобождения серотонина и снижению его содержания в синаптической щели. Кроме этого, золми-триптан оказывает действие на центры ствола головного мозга, ответственные за развитие мигрени, что объясняет устойчивый повторный эффект при лечении серии приступов мигрени у одного пациента.
После приема внутрь золмитриптан быстро и хорошо всасывается в пищеварительном тракте; прием пищи не влияет на абсорбцию препарата. Абсолютная биодоступность — около 40%. Максимальная концентрация в плазме крови достигается через 2 ч после приема. Средний период полувыведения золмитриптана и его активного метаболита — около 3 ч. Связывание с белками плазмы крови низкое (приблизительно 25%). Метаболизируется препарат в печени с образованием активного N-десметил-метаболита и двух неактивных — индолуксусной кислоты и N-оксид-метаболита. Агонистическое влияние активного метаболита в отношении 5НТ1-рецепторов в 2–6 раз превосходит исходное соединение. При повторном приеме аккумуляция не наблюдается. Более 60% введенной дозы выводится с мочой преимущественно в виде индолуксусного метаболита и около 30% — с калом в неизмененном виде. Почечный клиренс золмитриптана и его метаболитов у пациентов с умеренной и выраженной почечной недостаточностью уменьшен в 7–8 раз. Известно, что фармакокинетика золмитриптана не изменяется у лиц пожилого возраста [12].
В исследовании С.М. Spencer et al. была показана эффективность золмитриптана при лечении мигрени, связанной с менструацией, и мигрени с аурой, персистирующей и/или повторяющейся мигрени. Также золмитриптан был эффективен при облегчении таких симптомов мигрени, как тошнота, фото- и фонофобия. Для облегчения головной боли при мигрени золмитриптан в дозировке 5 мг имел сходную эффективность с суматриптаном в дозе 100 мг при однократном приступе, но, как правило, был более эффективен, чем суматриптан в дозах 25 и 50 мг для многократных приступов. Золмитриптан, как правило, хорошо переносится пациентами, вызывает меньшее количество нежелательных побочных эффектов. Наиболее частыми нежелательными явлениями при терапии золмитриптаном являются астения, сухость во рту, тошнота, головокружение, сонливость, парестезия, боль в груди [13].
В крупном двойном рандомизированном исследовании сравнивали эффективность и переносимость золмитриптана (2,5 или 5 мг) и суматриптана (50 мг) для купирования до 6 умеренных и тяжелых приступов мигрени. В исследовании приняли участие 1522 пациента, из них 500 пациентов принимали золмитриптан 2,5 мг, 514 пациентов – золмитриптан в дозировке 5 мг, 508 пациентов – 50 мг суматриптана. В целом уменьшение интенсивности головной боли в течение 2 ч в этих группах составило 62,9%, 65,7% и 66,6% соответственно. Не было статистически значимых различий между 50 мг суматриптана и 2,5 мг золмитриптана (р = 0,12) или 5 мг (р = 0,80). Авторы пришли к выводу, что золмитриптан (2,5 или 5 мг) оказался столь же эффективным, как и суматриптан в дозировке 50 мг [14]. Однако в сравнительном исследовании была показана более высокая эффективность купирования приступа мигрени в течение 2 ч золмитриптаном в дозировке 2,5 мг, чем суматриптаном в дозировке 25 и 50 мг, хотя у 3,3% пациентов не было клинически значимых показателей. В данном исследовании авторами не было обнаружено различий в частоте побочных эффектов между золмитриптаном и суматриптаном [15].
В большом сравнительном исследовании 1445 пациентов с мигренью оценивалась эффективность золмитриптана (в дозе 2,5 мг и 5 мг) и суматриптана (в дозе 25 мг и 50 мг) [16]. Поскольку для большинства современных триптанов характерно купирование 2-х атак из 3-х, в данном исследовании анализировалось количество пациентов с постоянным эффектом (в 3-х последовательных приступах). Этот показатель был достоверно выше в группе золмитриптана (рис. 1).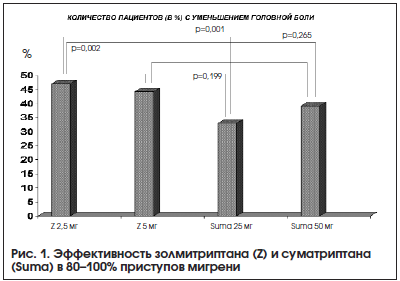
Триптаны противопоказаны при ишемической болезни сердца (ИБС), инсульте в анамнезе, неконтролируемой артериальной гипертензии (АГ), приеме некоторых лекарственных средств [17].
Вопрос о кардиобезопасности применения триптанов изучался специально в масштабных клинических исследованиях. В период с 1995 по 1999 г. в 20 штатах США с целью выявления серьезных кардиоваскулярных последствий мигрени и установления их возможной связи с применением современных антимигренозных средств проведено одно из самых больших проспективных популяционных исследований. В нем приняли участие 130 тыс. больных мигренью и примерно такое же количество больных, не страдающих мигренозными головными болями. В этих группах в течение всего периода наблюдения изучалась частота значимых кардиоваскулярных событий: инфаркта миокарда, инсульта, сердечных аритмий, нестабильной стенокардии, транзиторных ишемических атак (ТИА). Также анализировалась частота указанных событий у принимавших (50 383 пациента) и не принимавших (80 028 пациентов) селективные агонисты 5-НТ рецепторов. В целом у больных мигренью была выявлена более высокая частота ИБС, цереброваскулярных заболеваний, АГ и гиперлипидемии, а также нестабильной стенокардии и ТИА по сравнению с лицами, не страдающими мигренозными цефалгиями. Было показано, что в группе больных мигренью среди использовавших и не использовавших триптаны не было достоверных различий по частоте инфарктов миокарда, инсультов, сердечных аритмий, нестабильной стенокардии и ТИА, а частота смертельных случаев у пациентов, использующих триптаны, была даже ниже. Эти результаты позволили авторам прийти к заключению, что использование триптанов у больных мигренью не сопровождается увеличением риска значимых сердечно-сосудистых событий [18].
Таким образом, изучение этих селективных свойств триптанов имеет большое практическое значение для обоснования кардиобезопасности современных представителей данной группы препаратов. Сопоставление результатов клинических и экспериментальных исследований не позволяет связывать появление так называемых триптан-ассоциированных кардиальных жалоб с объективными кардиоваскулярными нарушениями у пациентов с мигренью. Для их объяснения следует изучить другие возможные неишемические причины этих расстройств. Их наличие может быть обусловлено генерализованными вазоспастическими реакциями, нарушением моторики пищевода, легочного кровообращения либо энергетического метаболизма скелетных мышц грудной стенки, а также развитием процессов центральной сенситизации [2]. Случаи серьезных кардиоваскулярных событий как в клинических испытаниях, так и в клинической практике наблюдаются крайне редко, и их появление не связано с фактом применения пациентами триптанов для купирования приступов головной боли. Профиль безопасности триптанов хорошо изучен. В соответствии с данными клинических исследований для пациентов без признаков коронарного заболевания триптаны характеризуются низким риском серьезных кардиоваскулярных побочных эффектов. Это позволяет рекомендовать пациентам с низким риском коронарного заболевания триптаны без предварительной оценки кардиального статуса.
Таким образом, для купирования приступа мигрени могут использоваться различные препараты. Выбор оптимального средства для купирования приступа мигрени среди существующего множества фармакологических средств является непростым для каждого пациента. С этой точки зрения оптимален стратифицированный подход, основанный на ранжировании мигренозных приступов по тяжести и степени нарушения адаптации пациентов. Пациентам с тяжелыми и умеренными приступами необходимо назначение специфических препаратов (триптанов) с учетом их высокой эффективности в клинических исследованиях. Так, основываясь на данных эффективности золми-триптана в сравнительных исследованиях, можно рекомендовать данный препарат в качестве приоритетного для симптоматической терапии мигрени. Также для успешного лечения необходимо динамическое наблюдение за пациентами. Крайне важно помнить, что допустимо для купирования приступов использовать не более 10 доз в месяц, чтобы избежать злоупотребления лекарствами и развития медикаментозно-индуцированной головной боли.
Источник
Мигрень – это болезнь, для которой типичны приступы пульсирующей выразительной головной боли, длительностью 4-72 часа. Болезненность сопровождается тошнотой, рвотой и другими неприятными вегетативными симптомами (повышенное потоотделение, озноб, полидипсия с полиурией, диарея…). Приступы включают гиперчувствительность к зрительным, слуховым, обонятельным стимулам (фотофобия, фонофобия, осмофобия). Между отдельными приступами пациент полностью здоров. Эти факторы учитывает диагностика мигрени, включающая ряд исследовательских методов.
Сбор анамнеза – опрос пациента
Основа для определения диагноза – тщательный анамнез (история болезни). Его сбор всегда начинается с семейной истории – врач интересуется присутствием заболевания у родителей, братьев, сестер, дедушек, бабушек. Известно, что мигрень встречается в семьях в течение нескольких поколений, т. е. при положительном семейном анамнезе человек имеет наследственную предрасположенность к мигрени.
Личный анамнез, применяемый в диагностике, включает наличие вредных привычек, аллергии. У женщин очень важна гинекологическая история, в частности, прием гормональных контрацептивов. В случае их использования, определяется присутствие или отсутствие изменения характера атак в зависимости от применения.
Следующий метод, как определить склонность к мигрени, заключается в опросе относительно возникновения болезни во время беременности – в этот период она часто исчезает.
Важно! А также определяется связь с менструальным циклом. Для женщин характерно проявление заболевания в период менструации.

Критерии, по которым диагностируется мигрень
Диагноз мигрени основан на классификации головной боли, разработанной в 1988 году. Хотя большинство специалистов по цефалгии и неврологов знакомы с критериями и формулировками этой классификации, их использование по-прежнему ограничено. Некоторые пациенты с симптомами мигрени не отвечают всем критериям, хотя хорошо реагируют на лечение. Поэтому обследованиям при мигрени следует уделять достаток внимания и времени.
На основании указанной классификации, заболевание делится на несколько типов:
Мигрень без ауры. Первоначально – «простая мигрень». Это головная боль, продолжающаяся 4-72 часа, у детей младше 15 лет – 2-48 часов, имеющая не менее 2-х характеристик:
- односторонняя локализация;
- импульсный характер;
- средняя и высокая интенсивность;
- ухудшение при нормальной физической активности.
Мигрень с аурой. Этот тип болезни должен удовлетворять не менее 3-х характеристик:
- полностью обратимые проявления ауры;
- не менее 1-го проявления ауры развивается более 4 минут;
- симптомы не длятся дольше 1 часа;
- время появления головной боли не превышает 1 часа после возникновения ауры, может начинаться до или одновременно с аурой.
Офтальмологическая мигрень. Болезненность связана с параличом головных нервов (3, 4, 6).
Ретинальная мигрень. Монокулярная скотома или слепота, продолжающаяся менее 1 часа, головная боль с последующими визуальными симптомами и отсутствием патологических офтальмологических обнаружений вне приступов.
Периодические детские синдромы. Они включают:
- детское ДППГ;
- детская чередующаяся гемиплегия.
Осложнения:
- status migrenosus – атаки, длящиеся более 3 суток;
- мигренозный инфаркт – неврологический дефицит, сохраняющийся до 1 недели.
Физикальный осмотр
В дополнение к классическому неврологическому тесту на мигрень, проводится, как минимум ориентировочное внутреннее обследование с измерением артериального давления. Важную роль в диагностике мигрени играет исследование шейного позвоночника – не только в рамках дифференциальной диагностики, но также и потому, что во время долговременной атаки мигрени часто возникает вторичная блокировка позвоночника.

Консультация у профильных специалистов
В целях исключения ряда заболеваний, в ходе диагностики мигрени, могут понадобиться обследования у нескольких специалистов, среди которых:
- окулист – обследование глазного дна, определение присутствия или исключение воспалений;
- стоматолог – определение присутствия или исключение воспалений, провоцирующих болезненность, сходную с мигренозной болью;
- ЛОР-специалист – определение присутствия или исключение синуситов, отитов, болезни Меньера;
- вертебролог – определение присутствия или исключение проблем с шейным позвоночником.
Инструментальные методы диагностики
Выводы морфологических диагностических исследований (рентген, компьютерная, магнитная томография) при мигрени нормальные. Запись ЭЭГ также показывает нормальные результаты. Важен в диагностике мигрени осмотр глаз, включая обследование глазного дна, измерение внутриглазного давления (острый приступ глаукомы может имитировать атаку мигрени!).
Из дополнительных исследований иногда рекомендуется SPECT-сканирование мозга, выявляющее нарушение мозгового кровообращения.
Важно! Вызываемые потенциалы и PET используются в основном для исследовательских целей.

Диагностические критерии
Диагностика мигрени без ауры:
- 5+ мигренозных атак, включающих проявления, описанные в пунктах 2-4.
- Продолжительность единичного приступа – 1-72 часа.
- Головная боль:
- односторонняя, реже двусторонняя;
- пульсирующая;
- интенсивная;
- усиливающаяся при нормальной физической активности.
- Наличие 1+ симптомов:
- тошнота;
- рвота;
- фотофобия;
- фонофобия.
- Исключение вторичной этиологии.
У 20% пациентов боли предшествует фаза ауры с разнообразными признаками, обычно исчезающими с возникновением болезненной фазы. Наиболее распространенная визуальная аура – сцинтилляционные узоры, другие явления природы скотомы или гемианопии. Также аура бывает сенсорной в виде парестезии на лице или конечностях. Редко она появляется в виде неполного выразительного лицевого расстройства или пареза.
Диагностика мигрени с аурой:
- 2+ мигренозные атаки, включающие проявления, описанные в пункте 2.
- 3+ из 4 критериев:
- 1+ признаков ауры, типичных для стволовой, кортикальной, фокальной дисфункции;
- 1+ признак развивается более 4 минут, иногда сочетается несколько симптомов;
- продолжительность проявлений не превышает 1 часа, при сочетании симптомов этот период продлевается;
- интервал между признаками и проявлениями ауры и болезненностью не превышает 1 часа.
- Вторичные типы цефалгии были исключены.
Дифференциальный диагноз
Дифференциация первичных головных болей (мигрень, тензионная, кластерная цефалгия и др.) довольно сложная. Важно отличить мигрень от головной боли других типов.
Тензионная цефалгия характеризуется тупой, давящей, менее интенсивной головной болью диффузной локализации. Отсутствует аура, сопровождающие симптомы редки, не очень интенсивны. Диагностика часто основывается на повышенном напряжении перикраниальных мышц. Приступы длится долго, до 7 дней.
Кластерная цефалгия – это относительно редкий тип первичной головной боли (0,5%), встречающийся преимущественно у мужчин (соотношение между мужчинами и женщинами 8:1). Диагностировать болезнь можно по следующим критериям:
- 1-8 атак в день за период от недели до месяцев;
- боли очень интенсивные, строго односторонние с периорбитальными пиками, распространяющиеся на более широкую область;
- приступ чаще всего встречается ночью;
- одна атака длится максимум 3 часа;
- характерны сопутствующие вегетативные симптомы: слезотечение на пораженной стороне, гиперемия конъюнктивы, слизистой оболочки носа, частичный синдром Хорнера.
Головные боли – это частый симптом при внутричерепных экспансивных процессах (опухоли, метастазы, абсцессы, субдуральные, эпидуральные гематомы и т. д.). Но обычно они не являются единственным признаком заболевания. Часто наблюдаются эпилептические приступы и другие очаговые проявления. Всегда требуется быстрое диагностическое решение (КТ, МРТ, ангиография).

Обструктивная гидроцефалия почти всегда сопровождается сильной болезненностью, усугубляющейся при чихании или напряжении.
Прогрессирующая цефалгия наблюдается при доброкачественной внутричерепной гипертензии. Типичны также зрительные нарушения, диплопия, рвота.
Те же симптомы часто присутствуют у пациентов с тромбозом внутричерепных пазух.
Болезненность, сходная с мигренонозной, присутствует при артериовенозной мальформации. Решающую роль в диагностике играет одновременное присутствие очаговых симптомов. Диагностика проводится ангиографией мозга.
Синусит – распространенная причина цефалгии. В диагностике важны клинические проявления и снимки полостей.
Менингит и энцефалит часто вызывают головную боль диффузного типа. Диагностика основывается на присутствии менингеального раздражения и гиперпирексии. Один из способов, как узнать о болезни – люмбальная пункция и исследование СМЖ.
Типичные «взрывные» головные боли указывают на возможность субарахноидального кровотечения. У 98% пациентов понять, что имеет место серьезное состояние можно с помощью диагностики КТ.
У 6-44% пациентов с ТИА наблюдается легкая или умеренная цефалгия, локализованная в основном на стороне поражения, продолжающаяся в течение нескольких часов. Около 20-30% пациентов с инсультом имеют аналогичную симптоматику.
Другими причинами болезненности являются:
- эндартерэктомия;
- диссекция сонных артерий.
Важно! При диссекции сонных артерий выявляется текущий синдром Хорнера и односторонний лобный тип головной боли.

КТ и МРТ
Нет диагностического теста или вспомогательного обследования, которое бы четко отвечало на вопрос, как распознать мигрень или другие первичные типы цефалгии. Методы визуализации – компьютерная томография и МРТ головного мозга – показаны для исключения вторичной этиологии и при изменении характера, частоты или интенсивности приступов.
Что делать – МРТ или КТ?
Если пациент испытывает типичные симптомы сильной мигрени в первый раз, КТ проводится для исключения субарахноидального кровотечения. Более легкий курс субарахноидального кровоизлияния может имитировать атаку мигрени. Однако, если симптомы сохраняются более 24 часов, КТ может быть ложно отрицательным. В этих случаях проводится исследование СМЖ, ангиография, МРТ.
При постановке диагноза не следует исключать офтальмологические исследования, способные выявить глазное заболевание, имитирующее мигренозный приступ.
Источник


